Растворимость - инертный газ
Cтраница 2
Существуют по крайней мере четыре основные причины, по которым перегревы перед закипанием жидких металлов выше, чем при закипании обычных жидкостей: 1) жидкие металлы обычно очень хорошо смачивают твердые металлические поверхности; 2) жидкие металлы, являясь химически активными, уменьшают количество поверхностных окислов; 3) растворимость инертных газов в жидких металлах возрастает с ростом температуры; 4) давления при кипении жидких металлов обычно значительно ниже критических. [16]
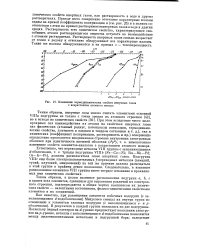 |
Изменение термодинамических свойств инертных газов с возрастанием атомного номера. [17] |
Прежде всего совершенно отчетливо характерные изломы видны на кривой коэффициента поляризации а ( см. рис. 26) и в полном соответствии с этим на кривых растворимости инертных газов в воде и других средах. Растворимость инертных газов сильно возрастает от гелия к радону и отчетливо обнаруживает все характерные изломы. Такие же изломы обнаруживаются и на кривых z - теплопроводность. [18]
Инертные газы относительно хорошо растворимы в воде. Растворимость инертных газов в воде, как и у всех газов, понижается с температурой и повышается с давлением. Если полученные под давлением водные растворы инертных газов охлаждать ниже 0, то из них кристаллизуются гидраты инертных газов, состав которых указан на стр. В этих гидратах атом инертного газа связан с молекулами воды вандерваальсовыми силами. Атомы инертных газов в их кристаллах связаны этими же силами ( см. стр. [19]
В воде растворяются относительно большие количества инертных газов. Как следует из этих данных, растворимость аргона в воде даже несколько превышает растворимость кислорода. Растворимость инертных газов в органических растворителях в некоторых случаях превышает их растворимость в воде. При низких температурах активированный уголь более или менее энергично поглощает все инертные газы, за исключением гелия ( ср. В отличие от водорода гелий не диффундирует через раскаленную платину. Однако при повышенных температурах он ( как и водород) диффундирует через кварцевое стекло. [20]
В качестве такого примера можно привести молекулы гидрохинона и его молекулярные соединения, структуры которых были подробно описаны во второй главе. Обычные молекулярные соединения, образуемые гидрохиноном с инертными газами, имеют формулу ЗС6Н4 ( ОН) а - М, где М - атом инертного газа. Эти соединения необходимо получать при высоком давлении из-за низкой растворимости включаемых газов. Для предотвращения разложения не требуется давления, потому что однажды захваченный атом газа удерживается силами решетки. Растворимость инертных газов в воде увеличивается с увеличением атомного номера, а чем выше растворимость, тем больше вероятность у атома инертного газа оказаться в подходящем месте при включении, и можно предсказать, что наиболее легко будет образовываться клатрат гидрохинона с инертным газом, атомный номер которого наибольший. [21]
В работе изучалась растворимость инертных по отношению к сплаву газов - аргона, гелия и азота. Методика определения количества растворенных инертных газов принципиально не отличалась от методики, описанной выше, применительно к водороду. Растворимость газов была определена для сплава, находящегося при 300 С. Наши данные согласуются с данными [4] по растворимости гелия в чистом калии, экстраполированными в область температур 300 С. Изданных, приведенных на рис. 5, следует, что растворимость инертных газов в основном определяется природой растворителя, а не растворяемых газов. [22]
Страницы: 1 2