Растворимость - галогенид - серебро
Cтраница 1
Растворимость галогенидов серебра падает от фторида к иодиду. [1]
Растворимость галогенидов серебра падает от фторида к иодпду. [2]
Растворимость галогенидов серебра падает от фторида к иодиду. [3]
Растворимость галогенидов серебра в воде увеличивается в последовательности: Agl ( К 8 3 - 10 - 17) А Вг ( К 5 3 Ю 13) AgCl ( K 1 78 - 1 ( Г10), где в скобках приведены значения произведений растворимости при комнатной температуре. Поэтому вначале будет образовываться желтый осадок иодида серебра, как наименее растворимого; на хрома-тограмме будет наблюдаться желтая ( верхняя) зона. В последнюю очередь образуется белый осадок хлорида серебра - нижняя белая зона, темнеющая на свету вследствие фотохимического разложения хлорида серебра с выделением мелкодисперсного металлического серебра. [4]
Растворимость хромата серебра значительно выше растворимости галогенидов серебра. Поэтому при титровании по методу Мора хромат серебра не будет образовываться до тех пор, пока не осядет практически весь галогенид. Регулируя концентрацию хромата, можно предотвратить образование хромата серебра до тех пор, пока концентрация ионов серебра не достигнет теоретически рассчитанной для области точки эквивалентности при титровании галогенида. [5]
С увеличением температуры водного раствора растворимость галогенидов серебра значительно повышается. Вследствие этого точность определения понижается. Чем больше растворимость осаждаемого соединения, тем больше ионов остается в растворе в точке эквивалентности. Так как в процессе объемно-аналитического определения нельзя приливать избыток осадителя, уменьшающего растворимость осадка, то концентрация остающегося в растворе определяемого иона может достигать значительной величины. С целью уменьшения растворимости понижают температуру титруемого раствооа до 10 - 15 С. [6]
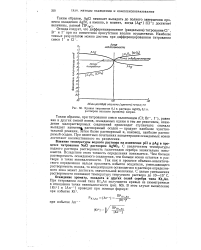 |
Кривая титрования 0 1 н. раствора AgNO3 0 1 н. раствором оксалата ( хромата натрия. [7] |
С увеличением температуры водного раствора растворимость галогенидов серебра значительно повышается. Вследствие этого точность определения понижается. Чем больше растворимость осаждаемого соединения, тем больше ионов остается в растворе в точке эквивалентности. Так как в процессе объемно-аналитического определения нельзя приливать избыток осадителя, уменьшающего растворимость осадка, то концентрация остающегося в растворе определяемого иона может достигать значительной величины. С целью уменьшения растворимости понижают температуру титруемого раствора до ГО-15 С. [8]
С увеличением температуры водного раствора растворимость галогенидов серебра значительно повышается. Вследствие этого точность определения понижается. Чем больше растворимость осаждаемого соединения, тем больше ионов остается в растворе в точке эквивалентности. Так как в процессе объемно-аналитического определения нельзя приливать избыток осадителя, уменьшающего растворимость осадка, то концентрация остающегося в растворе определяемого иона может достигать значительной величины. С целью уменьшения растворимости понижают температуру титруемого раствора до 10 - 15 С. [9]
Пользуясь табличными данными о произведениях растворимости галогенидов серебра, рассчитывают порядок расположения зон осадков и сопоставляют полученный экспериментально с расчетным. Определяют качественный состав исследуемого раствора. [10]
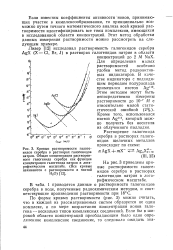 |
Кривые растворимости галоге -. v i Y - A Ym. [11] |
В табл. 1 приводятся данные о растворимости галогенидов серебра в воде, полученные радиохимическим методом, и соответствующие произведения растворимости при 18 С. [12]
 |
Растворимость некоторых неорганических солей в жидком аммиаке ( 25 С, г / 100 г, МН3. [13] |
Причем в отличие от растворимости в воде растворимость галогенидов серебра и щелочных металлов в жидком аммиаке изменяется в следующем порядке: иодидыбромидыхлоридыфториды. [14]
 |
Кривая последовательного титрования снеси ионов иодида, бромида и хло - 1 рида раствором нитрата серебра. [15] |
Страницы: 1 2 3