Сопряженная растворимость
Cтраница 1
Сопряженная растворимость очень сильно зависит от присутствия электролитов, их концентрации и, следовательно, от среды. [1]
Сопряженная растворимость может снижать высаливающее действие электролитов. [2]
Явление сопряженной растворимости отрицательно сказывается на свойствах многих растворителей. [3]
Продукты поликонденсации в силу сопряженной растворимости [26] переходят в раствор натриевых солей жирных кислот и в дальнейшем, при выделении последних, входят в их состав, увеличивая содержание нелетучего кубового остатка. [4]
 |
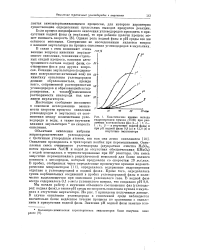
Топохимическая схема эмульсионного окисления углеводородов. [5] |
Кроме специфического влияния эмульгатора на распад гидроперекиси, необходимо учитывать также и сопряженную растворимость гидроперекиси в водной фазе. Увеличение ее концентрации в водной фазе содействует генерированию свободных радикалов по приведенной выше схеме. Однако накопление гидроперекиси в водной фазе может происходить только до предела, определяемого ее растворимостью. При дальнейшем увеличении содержания гидроперекиси в реакционной смеси она переходит в углеводородную фазу ( капли углеводорода), где ее распад протекает значительно медленнее. Таким образом, углеводородная фаза является своеобразным депо гидроперекиси. В связи с этим становится понятным уменьшение стабильности эмульсии в ходе процесса. При значительном накоплении гидроперекиси в углеводородной фазе она адсорбируется на границе раздела фаз вследствие того, что она имеет поверхностную активность. [6]
Увеличение температуры ( в опытах до 50 - 60) повышает, как правило, коллоидную или сопряженную растворимость в воде. [7]
 |
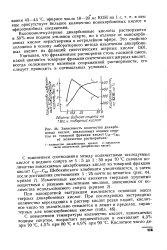
Кинетические кривые выхода гидроперекиси кумола ( ГПК при различных соотношениях фаз ( 1 - 1. 1. 2 - 3 - в отсутствие водной фазы и при рН водной фазы 9 9 ( а и 12 0 ( 6 в отсутствие эмульгатора. [8] |
Влияние эмульгаторов ( содержащих поверхностно-активный ион) на кинетику окисления углеводородов должно обусловливаться, прежде всего, сопряженной растворимостью углеводородов и образовавшейся гидроперекиси, а та кже [ изменением растворимости кислорода под вли-янием эмульгаторов. [9]
 |
Зависимость количества дикарбоновых кислот, извлекаемых водным спиртом из товарной фракции кислот С17 - С2в, от количества растворителя. [10] |
Учитывая, что фракционное растворение столь сложной смеси, какой являются товарные фракции синтетических жирных кислот, всегда осложняется явлением сопряженной растворимости, его следует проводить в оптимальных условиях. [11]
При непрерывном окислении жидких парафинов ЛенНИИ предлагает оксидат по выходе из колонны нейтрализовать водным раствором едкого натра. В образующийся раствор мыла в силу сопряженной растворимости переходят спирты, углеводороды и другие кислородные соединения. Эти продукты, так называемые не-омыляемые - П, из мыльного раствора извлекали экстракцией серным эфиром. [12]
В этом случае, как это было показано в работах А. И. Юрженко [1] и Харкинса [2], роль эмульгатора далеко не может быть сведена только к стабилизации эмульсии полимеризующегося углеводорода. Эмульгирующий агент обусловливает в данном случае частичный переход углеводорода в водную фазу ( вследствие сопряженной растворимости), в которой в основном и проходит химическая реакция. Таким образом, в случае проведения химического процесса в эмульсии, нужно знать не только механизм процесса, но и его топохимию. [13]
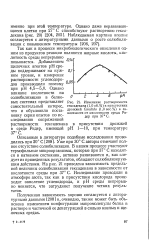 |
Изменение растворимости гексадекана ( 1 0 об. % в присутствии дрожжей Candida ( 1 0 вес. % в зависимости от кислотности среды Ри-дер при 37е С. [14] |
Так как в процессе микробиологического окисления одним из продуктов реакции являются жирные кислоты, кислотность среды непрерывно повышается. Однако влияние кислотности на солюбилизацию в белковых системах представляет самостоятельный интерес, что и обусловило постановку серии опытов по исследованию сопряженной растворимости гексадекана в присутствии дрожжей в среде Ридер, имеющей рН 1 - 10, при температуре 37 С. [15]
Страницы: 1 2