Кривая растворимость - соль
Cтраница 1
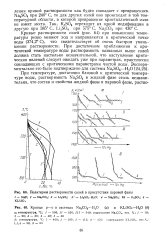 |
Политермы растворимости солей в присутствии паровой фазы.| Кривые p - v в системах Na2CO3 - H2O ( а и KLiSO4 - H2O ( б. [1] |
Кривые растворимости солей ( рис. 64) при повышении температуры резко меняют ход и направляются к критической точке воды ( 374 2 С), что свидетельствует об очень быстром уменьшении растворимости. При достаточном приближении к критической температуре воды растворимость названных выше солей должна стать настолько незначительной, что наступление критических явлений следует ожидать уже при параметрах, практически совпадающих с критическими параметрами чистой воды. [2]
Сопоставление кривых растворимости танталовой и ниобие-вой соли ( рис. 59) показывает, что дробную кристаллизацию солей тантала и ниобия наиболее выгодно проводить при концентрации HF 1 - 7 %, так как в этой области ( в которой устойчива соль K2NbOF5 Н2О) различие в растворимости танталовой и ниобиевой соли достигает наибольшей величины. [3]
Наиболее простой вид имеют кривые растворимости солей, не изменяющих своей кристаллической модификации, не образующих кристаллогидратов и двойных солей. [4]
Наиболее простой вид имеют кривые растворимости солей, не изменяющих своей кристаллической модификации и не образующих кристаллогидратов. Рассмотрим изображенную на рис. 19 диаграмму растворимости в воде одной соли, кристаллизующейся в безводном виде. [5]
Наиболее простой вид имеют кривые растворимости солей, не изменяющих своей кристаллической модификации, не образующих кристаллогидратов и двойных солей. [6]
Из перечисленных выше типов кривых растворимости соли в воде в технологии солей чаще всего встречаются диаграммы со скрытым максимумом, реже кривые без гидратных форм и в отдельных случаях - диаграммы с явным максимумом. Весьма обычны случаи образования ряда последовательных кристаллогидратов, каждый из которых характеризуется отдельным участком на кривой растворимости. [7]
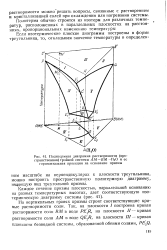 |
Политермная диаграмма растворимости ( пространственная тройной системы АМ-ВМ - Н2О и ее горизонтальная проекция на основание призмы. [8] |
На вертикальных гранях призмы строят соответствующие кривые растворимости соли. [9]
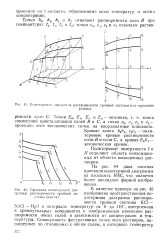 |
Полптермная диаграмма растворимости тройной системы и ее проекции.| Проекция политермной диа. [10] |
Кривые линии Ь0Ь3 с0с3 - поли-термные кривые растворимости соли В и соли С, а кривая Е0Е3 - эвтоническая кривая. [11]
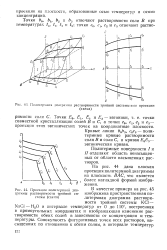 |
Политер. мная диаграмма растворимости тройной системы и ее проекции.| Проекция политермной дна - в качестве примера на 45. [12] |
Кривые линии Ь0Ь3, с0с3 - поли-термные кривые растворимости соли В и соли С, а кривая Е0Е3 - эвтоническая кривая. [13]
В то же время в изменениях кривых растворимости солей в присутствии в растворах других электролитов отражаются действия нл растворимость солей всех факторов, и мы, имея падежные источники информации, вооружаемся данными, на основании которых приобретаем возможность для раскрытия природы происходящих в растворах явлений и данные для составления количественных, математических зависимостей. [14]
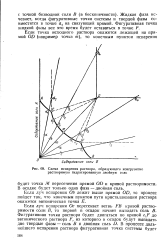 |
Схема испарения раствора, образующего конгруэнтно растворимую гидратированную двойную соль. [15] |
Страницы: 1 2 3 4