Низкая растворимость - кислород
Cтраница 1
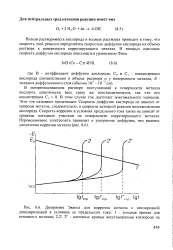 |
Диаграмма Эванса для коррозии металла с кислородной деполяризацией в условиях ее предельного тока. 1 - анодная кривая для основного металла. 2 2, 2 - катодные кривые восстановления кислорода на. [1] |
Низкая растворимость кислорода в водных растворах приводит к тому, что скорость этой реакции определяется скоростью диффузии кислорода из объема раствора к поверхности коррозирующего металла. [2]
 |
Поляризационные кривые анодного растворения металлов ( ji - и j1., выделения водорода ( у и восстановления кислорода ( / з. [3] |
Из-за низкой растворимости кислорода на поляризационной кривой его восстановления имеется участок предельного тока диффузии. Так, при саморастворении металла I играют роль лишь реакции выделения водорода и растворения металла. Саморастворение металла II происходит примерно в равной степени за счет выделения водорода и восстановления кислорода. [4]
Однако скорость этого процесса мала из-за низкой растворимости кислорода в концентрированном растворе КОН и, как следствие, малого значения диффузионного тока tis. Вклад в саморазряд Н К-аккумулятор а вносит и положительный электрод, снижающий при хранении степень окислешюсти никеля с выделением кислорода. [5]
Однако скорость этого процесса мала из-за низкой растворимости кислорода в концентрированном растворе КОН и, как следствие, малого значения диффузионного тока Аэ2 - Вклад в саморазряд НК-аккумулятора вносит и положительный электрод, снижающий при хранении степень окисленности никеля с выделением кислорода. [6]
 |
Разрядные характеристики никель-кадмиевого ламельного аккумулятора зависимости от тока нагрузки, кратного номинальной емкости Сном. [7] |
Однако скорость этого процесса мала из-за низкой растворимости кислорода в концентрированном растворе КОН и, как следствие, малого значения диффузионного тока / ог. Вклад в саморазряд НК-аккумулятора вносит и положительный электрод, снижающий при хранении степень окисленности никеля с выделением кислорода. [8]
 |
Поляризационные кривые анодного растворения металлов. [9] |
На рис. 189 приведены парциальные поляризационные кривые, отвечающие растворению металла, выделению водорода и восстановлению кислорода, а также суммарная поляризационная кривая t s выделения водорода и восстановления кислорода. Из-за низкой растворимости кислорода на поляризационной кривой его восстановления имеется участок предельного тока диффузии. Так, при саморастворении металла I играют роль лишь реакции выделения водорода и растворения металла. Саморастворение металла II происходит примерно в равной степени за счет выделения водорода и восстановления кислорода. Наконец, для металла III процесс саморастворения осуществляется в основном за счет восстановления кислорода. Аналогичное явление наблюдается и в присутствии азотной кислоты, когда растворение металлов сопровождается одновременным выделением продуктов ее восстановления. [10]
 |
Взаимодействие кислорода с переходными металлами Диаграммы состояния Me - О. [11] |
Переход к ванадию, ниобию и танталу сопровождается сжатием ОЦК решетки, уменьшением размеров металлических атомов и междоузлий и уменьшением вследствие этого растворимости кислорода. Дальнейшее сжатие решетки при переходе к хрому, молибдену и вольфраму приводит к почти полному выклиниванию первичных областей растворов внедрения и очень низкой растворимости кислорода в этих металлах. [12]
Для культуральной жидкости, насыщенной воздухом при температуре 25 С, величина С составляет примерно 0 20 ммоль. Генри т будет приближенно равна единице. Низкая растворимость кислорода является важным фактором при рассмотрении вопроса подачи кислорода к дышащим культурам. [13]
На Первом Всесоюзном совещании по радиационной химии [2] в 1957 г. были выявлены три основных направления в области радиационного окисления органических веществ. Коренное различие газофазных и жидкофазных процессов заключается в том, что в жидкофазных процессах воздействие излучения происходит только на органическое вещество из-за низкой растворимости кислорода ( 10 - 2М при атмосферном давлении), в то время как в газовой фазе соотношение органического вещества и кислорода может быть любым и, следовательно, в ряде случаев необходимо учитывать воздействие излучения на кислород. [14]
Увеличение концентрации ионов хлора снижает температуру начала коррозионного процесса в щели и объеме раствора. Кроме того, лабораторные коррозионные испытания показали, что важным фактором коррозионного поведения титана в растворах хлоридов является наличие кислорода как деполяризатора в жидкой и газовой фазах. Найдено, что защитное действие кислорода в растворах при 160 С проявляется при содержании не менее 15 % ( объемных) в газовой фазе. Однако содержание растворенного кислорода в условиях работы выпарных аппаратов значительно меньше вследствие малого объема газовой фазы ( по отношению к жидкой) и низкой растворимости кислорода в NH4CI при высоких температурах. [15]
Страницы: 1