Непротонный растворитель
Cтраница 1
Непротонные растворители - это растворители, не имеющие в своем составе водорода. Так как диэлектрическая проницаемость их обычно очень мала, то соединения, относящиеся к этой группе, не могут быть использованы в качестве растворителей для реакции электрохимического синтеза. [1]
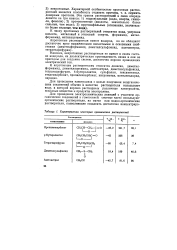 |
Характеристика некоторых органических растворителей. [2] |
Наконец, непротонные растворители не имеют в своем составе водорода, их диэлектрическая проницаемость низка и они не пригодны для создания систем, достаточно хорошо проводящих электрический ток. [3]
Классификация, основанная на представлениях Бренстеда - Льюиса о кислотах, различает протонные и непротонные растворители. Часто ее применяют к растворителям, которые путем автоионизации образуют сольватированный протон, таким, как вода, фтористоводородная кислота, аммиак, спирты с малым молекулярным весом. Однако лучшей разновидностью классификации того же направления служит разделение растворителей по протофильному характеру. [4]
Хотя исторически теория сольво-систем для кислотно-основного взаимодействия существовала до протонной теории, все же последняя будет удовлетворительна только для протонных растворителей и непригодная для непротонных растворителей. Изучение таких растворителей, как COCU; SeOCU и SO2, показало, что взаимодействия кислотно-основного типа можно наблюдать и в таких системах, в которых протон совсем не участвует. Было предложено мш5го разных теорий 4 5, в которых делались попытки применить кислотно-основные представления к процессам в разных непротонных растворителях. Пользуясь определением Кэди и Элсей, можно сказать, что кислота есть растворимое вещество, способное или прямой диссоциацией, или посредством реакции с растворителем образовать катион, характерный для растворителя; основание есть растворимое вещество, которое путем диссоциации или взаимодействия с растворителем дает анион, характерный для растворителя. [5]
Широко распространены методы с использованием растворителя. В качестве растворителя могут служить водные растворы галогеноводородов, спиртовый раствор хлористого и бромистого водорода или один из разнообразных непротонных растворителей. Выбор зависит от особенностей комплекса, который необходимо получить. В табл. 8 указаны различные препаративные методы, имеющие широкое применение, хотя следует отметить, что этот список не исчерпывающий и, как будет видно из дальнейшего, имеются различные методы для получения многих соединений. [6]
Хотя исторически теория сольво-систем для кислотно-основного взаимодействия существовала до протонной теории, все же последняя будет удовлетворительна только для протонных растворителей и непригодная для непротонных растворителей. Изучение таких растворителей, как COCU; SeOCU и SO2, показало, что взаимодействия кислотно-основного типа можно наблюдать и в таких системах, в которых протон совсем не участвует. Было предложено мш5го разных теорий 4 5, в которых делались попытки применить кислотно-основные представления к процессам в разных непротонных растворителях. Пользуясь определением Кэди и Элсей, можно сказать, что кислота есть растворимое вещество, способное или прямой диссоциацией, или посредством реакции с растворителем образовать катион, характерный для растворителя; основание есть растворимое вещество, которое путем диссоциации или взаимодействия с растворителем дает анион, характерный для растворителя. [7]
Аммоно - и аква-системы кислот и оснований формально очень похожи. Это становится очевидным, если рассматривать ион аммония и ион гидроксония как сольватированный протон. Хотя исторически теория сольво-систем для кислотно-основного взаимодействия существовала до протонной теории, все же последняя будет удовлетворительна только для протонных растворителей и непригодна для непротонных растворителей. Изучение таких растворителей, как СОС12; 5еОС12 и SO2, показало, что взаимодействия кислотно-основного типа можно наблюдать и в таких системах, в которых протон совсем не участвует. Было предложено много разных теорий [4, 5], в которых делались попытки применить кислотно-основные представления к процессам в разных непротонных растворителях. Пользуясь определением Кэди и Элсей, можно сказать, что кислота есть растворимое вещество, способное или прямой диссоциацией или посредством реакции с растворителем образовать катион, характерный для растворителя; основание есть растворимое вещество, которое путем диссоциации или взаимодействия с растворителем дает анион, характерный для растворителя. [8]
Аммоно - и акво-системы кислот и оснований формально очень похожи. Это становится очевидным, если рассматривать ион аммония и ион гидроксония как сольватированный протон. Хотя исторически теория сольво-систем для кислотно-основного взаимодействия существовала до протонной теории, все же последняя будет удовлетворительна только для протонных растворителей и непригодна для непротонных растворителей. Изучение таких растворителей, как СОС12; SeOCI2 и SO2, показало, что взаимодействия кислотно-основного типа можно наблюдать и в таких системах, в которых протон совсем не участвует. Было предложено много разных теорий4 5, в которых делались попытки применить кислотно-основные представления к процессам в разных непротонных растворителях. Пользуясь определением Кэди и Ильей, можно сказать, что кислота есть растворимое вещество, способное или прямой диссоциацией, или посредством реакции с растворителем образовать катион, характерный для растворителя; основание есть растворимое вещество, которое путем диссоциации или взаимодействия с растворителем дает анион, характерный для растворителя. [9]
Аммоно - и акво-системы кислот и оснований формально очень похожи. Это становится очевидным, если рассматривать ион аммония и ион гидроксония как сольватированный протон. Хотя исторически теория сольво-систем для кислотно-основного взаимодействия существовала до протонной теории, все же последняя будет удовлетворительна только для протонных растворителей и непригодна для непротонных растворителей. Изучение таких растворителей, как СОС12; SeOCl2 n SO2, показало, что взаимодействия кислотно-основного типа можно наблюдать и в таких системах, в которых протон совсем не участвует. Было предложено много разных теорий4 5, в которых делались попытки применить кислотно-основные представления к процессам в разных непротонных растворителях. Пользуясь определением Кэди и Ильей, можно сказать, что кислота есть растворимое вещество, способное или прямой диссоциацией, или посредством реакции с растворителем образовать катион, характерный для растворителя; основание есть растворимое вещество, которое путем диссоциации или взаимодействия с растворителем дает анион, характерный для растворителя. [10]
Аммоно - и акво-системы кислот и оснований формально очень похожи. Это становится очевидным, если рассматривать ион аммония и пои гндроксония как сольватированный протон. Хотя исторически теория сольво-систем для кислотно-основного взаимодействия существовала до протонной теории, все же последняя будет удовлетворительна только для протонных растворителей и непригодна для непротонных растворителей. Изучение таких растворителей, как СОС1; SeOCL и SO2, показало, что взаимодействия кислотно-основного типа можно наблюдать и в таких системах, в которых протон совсем не участвует. Было предложено много разных теорий4 5, в которых делались попытки применить кислотно-основные представления к процессам в разных непротонных растворителях. Пользуясь определением Кдди и Ильей, можно сказать, что кислота есть растворимое вещество, способное или прямой диссоциацией, или посредством реакции с растворителем образовать катион, характерный для растворителя; основание есть растворимое вещество, которое путем диссоциации или взаимодействия с растворителем дает анион, характерный для растворителя. [11]
Аммоно - и акво-системы кислот и оснований формально очень похожи. Это становится очевидным, если рассматривать ион аммония и ион гидроксония как сольватированный протон. Хотя исторически теория сольво-систем для кислотно-основного взаимодействия существовала до протонной теории, все же последняя будет удовлетворительна только для протонных растворителей и непригодна для непротонных растворителей. Изучение таких растворителей, как СОС12; SeOCI2 и SO2, показало, что взаимодействия кислотно-основного типа можно наблюдать и в таких системах, в которых протон совсем не участвует. Было предложено много разных теорий4 5, в которых делались попытки применить кислотно-основные представления к процессам в разных непротонных растворителях. Пользуясь определением Кэди и Ильей, можно сказать, что кислота есть растворимое вещество, способное или прямой диссоциацией, или посредством реакции с растворителем образовать катион, характерный для растворителя; основание есть растворимое вещество, которое путем диссоциации или взаимодействия с растворителем дает анион, характерный для растворителя. [12]
Аммоно - и акво-системы кислот и оснований формально очень похожи. Это становится очевидным, если рассматривать ион аммония и ион гидроксония как сольватированный протон. Хотя исторически теория сольво-систем для кислотно-основного взаимодействия существовала до протонной теории, все же последняя будет удовлетворительна только для протонных растворителей и непригодна для непротонных растворителей. Изучение таких растворителей, как СОС12; SeOCl2 n SO2, показало, что взаимодействия кислотно-основного типа можно наблюдать и в таких системах, в которых протон совсем не участвует. Было предложено много разных теорий4 5, в которых делались попытки применить кислотно-основные представления к процессам в разных непротонных растворителях. Пользуясь определением Кэди и Ильей, можно сказать, что кислота есть растворимое вещество, способное или прямой диссоциацией, или посредством реакции с растворителем образовать катион, характерный для растворителя; основание есть растворимое вещество, которое путем диссоциации или взаимодействия с растворителем дает анион, характерный для растворителя. [13]
Аммоно - и аква-системы кислот и оснований формально очень похожи. Это становится очевидным, если рассматривать ион аммония и ион гидроксония как сольватированный протон. Хотя исторически теория сольво-систем для кислотно-основного взаимодействия существовала до протонной теории, все же последняя будет удовлетворительна только для протонных растворителей и непригодна для непротонных растворителей. Изучение таких растворителей, как СОС12; 5еОС12 и SO2, показало, что взаимодействия кислотно-основного типа можно наблюдать и в таких системах, в которых протон совсем не участвует. Было предложено много разных теорий [4, 5], в которых делались попытки применить кислотно-основные представления к процессам в разных непротонных растворителях. Пользуясь определением Кэди и Элсей, можно сказать, что кислота есть растворимое вещество, способное или прямой диссоциацией или посредством реакции с растворителем образовать катион, характерный для растворителя; основание есть растворимое вещество, которое путем диссоциации или взаимодействия с растворителем дает анион, характерный для растворителя. [14]
Аммоно - и акво-системы кислот и оснований формально очень похожи. Это становится очевидным, если рассматривать ион аммония и пои гндроксония как сольватированный протон. Хотя исторически теория сольво-систем для кислотно-основного взаимодействия существовала до протонной теории, все же последняя будет удовлетворительна только для протонных растворителей и непригодна для непротонных растворителей. Изучение таких растворителей, как СОС1; SeOCL и SO2, показало, что взаимодействия кислотно-основного типа можно наблюдать и в таких системах, в которых протон совсем не участвует. Было предложено много разных теорий4 5, в которых делались попытки применить кислотно-основные представления к процессам в разных непротонных растворителях. Пользуясь определением Кдди и Ильей, можно сказать, что кислота есть растворимое вещество, способное или прямой диссоциацией, или посредством реакции с растворителем образовать катион, характерный для растворителя; основание есть растворимое вещество, которое путем диссоциации или взаимодействия с растворителем дает анион, характерный для растворителя. [15]
Страницы: 1