Любой растворитель
Cтраница 1
Любой растворитель, обеспечивающий переход противоионов от осмотически неактивного ( неподвижного) состояния к осмотически активному ( подвижному) выступает подобно воде, в роли конкурента фиксированных ионов за сольватацию противоионов. В связи с этим появление растворителя должно приводить к уменьшению зависимости сольватирующей способности фазы ионита от относительного содержания противоионов. Причем уменьшение это, количественной мерой которого является - приближенно - разность углов наклона зависимостей KJJ - состав и х - состав, будет зависеть от того, насколько велика конкурентноспособность растворителя. Мерой последней в первом приближении является величина диэлектрической постоянной растворителя. [1]
Любые растворители влияют на константу равновесия и тем в большей степени, чем больше их взаимодействие хотя бы с одним из компонентов комплекса и чем слабее комплекс. В наибольшей степени при прочих равных условиях равновесие А Д АД сдвинуто вправо в газообразном состоянии. [2]
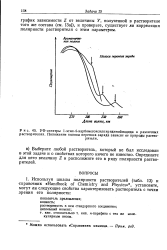 |
УФ-спектры 1-этил - 4-карбометоксилпиридинийиодида в различных растворителях. Положение полосы переноса заряда зависит от природы растворителя. [3] |
Выберите любой растворитель, который не был исследован в этой задаче и о свойствах которого ничего не известно. [4]
Не любые растворители, применяемые в лакокрасочной про-ышленности [ 97, с. [5]
В любом растворителе чем больше ионы, тем больше степень диссоциации. [6]
В любом растворителе всегда присутствуют мельчайшие частички пыли. На этих твердых частичках в результате ионообменной и молекулярной адсорбции происходит осаждение ионных и молекулярных форм радиоактивного изотопа. Образуется псевдоколлоидный раствор радиоактивного изотопа. [7]
В любом растворителе произведение кислотной и основной констант данного протолита равно константе автопротолиза растворителя. [8]
В любом растворителе - спирте или четыреххлористом углероде - в процессе растворения разрушается кристаллическая решетка иода и образуется неупорядоченный раствор. Процесс растворения увеличивает неупорядоченность. Эта тенденция обусловливает растворение. [9]
В любом растворителе за стандартный электрод всегда принимается водородный, а электрод сравнения ( обычно каломельный электрод; хлор-серебряный электрод имеет ограниченное применение) содержит тот же неводный растворитель, в котором проводятся исследования. Вместо водородного можно использовать стеклянный, хингидрон-ный или сурьмяный электроды. [10]
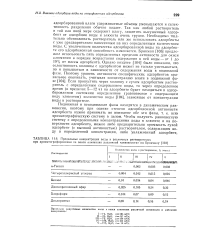 |
Предельные концентрации воды в различных растворителях. [11] |
Так как любой растворитель в той или иной мере содержит влагу, защитить высушенный адсорбент от адсорбции воды и элюента очень трудно. Необходимо тщательно обезвоживать растворитель или же использовать адсорбенты с уже предварительно нанесенным на них определенным количеством воды. С увеличением количества адсорбированной воды на адсорбенте его адсорбционная способность изменяется. [12]
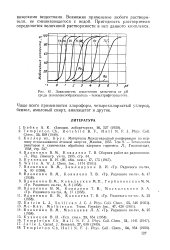 |
Зависимость извлечения элементов от рН среды ( комплексосбразователь - теноилтрифторацетон. [13] |
Возможно применение любого растворителя, не смешивающегося с водой. Пригодность растворителя определяется величиной растворимости в нем данного комплекса. [14]
Главным показателем любого растворителя является его растворяющая способность, которая определяется прежде всего соотношением полярностей растворителя и растворяемого вещества. Существенное значение для растворителей имеют пространственные факторы: размеры молекул, число и объем заместителей у конкретных углеродных атомов. Низкие поверхностное натяжение и вязкость обусловливают повышение растворяющей способности. [15]
Страницы: 1 2 3 4