Неорганический растворитель
Cтраница 1
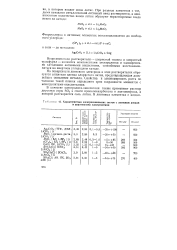 |
Характеристики электрохимических систем с литиевым анодом и апротонными электролитами. [1] |
Неорганические растворители - хлористый тионил и хлористый сульфурил - являются компонентами электролитов и одновременно катодными активными веществами, способными восстанавливаться на инертном углеродном катоде. [2]
Другими неорганическими растворителями солей являются кислоты ( НС1, H2SO4, HF) и водные растворы солей NaCl, K. [3]
Число применяемых неорганических растворителей весьма ограничено. [4]
Воздействие различных неорганических растворителей на нитрид бора характеризуется данными табл. 5 - 15; как видно из этой таблицы, в большинстве случаев нитрид бора обладает достаточной стойкостью к действию многих растворителей. [5]
 |
Диэлектрическая проницаемость растворителей при температуре 298 15 К. [6] |
К наиболее распространенным неорганическим растворителям относятся жидкие аммиак, оксиды азота и серы, фтористый водород, галогены, трихлорид сурьмы, пентахлорид сурьмы, хлористый сульфурил, тионил-галогениды, хлористый селенил, фосфороксихлорид, серная, азотная и фторсульфоновая кислоты и многие другие. Указанные растворители обладают рядом ценных свойств. Например, серная кислота - хороший растворитель для электролитов, поскольку обладает высокой диэлектрической проницаемостью, значительной полярностью молекул, способных к образованию прочных водородных связей. [7]
Органические и некоторые неорганические растворители по способности растворять углеводороды ведут себя по-разному. Другая группа растворителей при комнатной температуре растворяет углеводороды в небольших количествах, а при большом их избытке образуются две жидкие фазы. В одной из фаз содержится углеводород ( нефтепродукт) с небольшой примесью растворителя, в другой растворитель содержит в растворенном виде часть углеводородов исходной фракции. При очень большом добавлении растворителя образуется единый раствор. [8]
Наибольшее значение из неорганических растворителей имеет вода; органические растворители более многочисленны. [9]
Самый обширный класс неводных неорганических растворителей составляют расплавленные соли; их используют в качестве хорошей среды для получения различных соединений. Они представляют собой ионные расплавы в широком температурном интервале. [10]
Он нерастворим в неорганических растворителях; в целом же ряде органических растворителей, как, на -, пример, в хлорированных углеводородах, сложных эфи-рах и кетонах растворяется хорошо. [11]
 |
Процессы фотолитографии, используемые при производстве полупроводниковых ИС. [12] |
Проявление производится в неорганических растворителях, В процессе проявления негативного фоторезиста вымываются неосвещенные участки изображения. Удаление растворителя достигается промывкой пластин в деионизовэнной воде, после чего они подвергаются сушке при температуре 60 - 100 а затем задубливанию фоторезиста при температуре 200 - 220 С. Эта операция повышает стойкость пленки фоторезиста к воздействию травящих растворов. [13]
По-видимому, аммиак - единственный неорганический растворитель, отличающийся от воды и серной кислоты, исследованию строения двойного слоя в котором было уделено внимание. Однако к нему проявляется меньший интерес из-за ограниченной области идеальной поляризуемости ртути вследствие анодного растворения металла, происходящего вблизи максимума электрокапиллярной кривой. Следовательно, изучение адсорбции анионов вообще невозможно. С аммиаком также трудно работать при атмосферном давлении. Точка кипения его ( - 33 4 С) близка к точке замерзания ртути ( - 38 9 С), что оставляет для исследований на жидкой ртути только область в 5 С. [14]
При воздействии на угли органических и неорганических растворителей из массы сложных веществ, их составляющих, выделяются более простые вещества или группы соединений. [15]
Страницы: 1 2 3 4