Чистый неводный растворитель
Cтраница 1
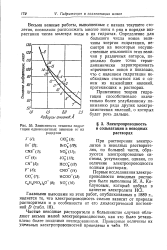 |
Зависимость теплоты гидратации одновалентных анионов от их радиусов. [1] |
Чистые неводные растворители в большинстве случаев обладают весьма малой электропроводностью, как это было установлено более поздними исследованиями. [2]
Ион-селективные электроды могут использоваться как в чистых неводных растворителях, так и в смесях с водой. [3]
Уравнение ( V, 80) отличается от уравнения для чистых неводных растворителей вторым членом; все остальные члены неизменны. [4]
Уравнение ( IV, 80) отличается от уравнения для чистых неводных растворителей вторым членом; все остальные члены неизменны. В пределе член V2 lg [ св / ( снв Krcv) ] при малых добавках воды равен 1 / 2 lg ( св / снв) [ или, пользуясь шкалой активности, Vjg ( ав / а, 1В) ], и, следовательно, уравнение ( IV, 80) переходит в ( IV, 75а) для чистых неводных растворителей. [5]
 |
Значения Е0 Д2Аох, Igy0, lgy0OCH -, lgT03JI - и А2СОл. для НС1 при 25. [6] |
Как видно из рис. 2, она является линейной функцией 1 / D в ряду чистых неводных растворителей одной химической природы. [7]
Однако следует отметить, что все эти авторы работали со смешанными растворителями, мы же хотели показать состоятельность приведенных выше количественных зависимостей при обмене ионов в чистых неводных растворителях. [8]
Ацетонит-рил предшествует метанолу в рядах, составленных по величине влияния растворителя, хотя диэлектрическая проницаемость ацетонит-рила существенно выше. Отметим, что последовательность параметров сольватаиии по Рейхардту [88] для чистых неводных растворителей совпадает с наблюдаемой последовательностью устойчивости комплексов в этих же растворителях. [9]
Это позволяет предположить, что диполь формамида ориентирован отрицательным концом и поэтому стабилизирован на положительно заряженном электроде. Следует упомянуть, что при сопоставлении потенциала максимума злектрока-пиллярной кривой и других потенциалов в смешанных и чистых неводных растворителях при использовании электрода сравнения в водном растворе возникает некоторая неопределенность из-за наличия диффузионного потенциала. [10]
Уравнение ( IV, 80) отличается от уравнения для чистых неводных растворителей вторым членом; все остальные члены неизменны. В пределе член V2 lg [ св / ( снв Krcv) ] при малых добавках воды равен 1 / 2 lg ( св / снв) [ или, пользуясь шкалой активности, Vjg ( ав / а, 1В) ], и, следовательно, уравнение ( IV, 80) переходит в ( IV, 75а) для чистых неводных растворителей. [11]
Именно в связи с исследованиями реакций изомеризации, сопровождающихся мутаротацией, Лаури высказал представление, которое можно назвать донорно-акцепторной теорией кислотно-основного катализа. Оказалось, что мутаротация различных соединений, легко протекающая в воде, не происходит в различных чистых неводных растворителях. В специально очищенных кварцевых сосудах и растворителях тетраацетил-глюкоза и тетраметилглюкоза остаются неизмененными длительное время, также в хлороформе, бензоле, метилацетате и других растворителях. [12]
Именно в связи с исследованиями реакций изомеризации, сопровождающихся мутаротацией, Лаури высказал представление, которое можно назвать донорно-акцепторной теорией кислотно-основного катализа. Во-первых, оказалось, что мутаротация различных соединений, легко протекающая в воде, не происходит в различных чистых неводных растворителях. [13]
Однако в этом случае мы встречаемся с рядом затруднений - Так, например, коэффициенты активности сильных кислот значительно больше отличаются от единицы, чем в водных растворах, сильные в воде кислоты становятся в неводпых растворах слабыми, хуже растворимы соли; значительно меньше имеется данных о коэффициентах активности - В настоящее время единственным веществом, с помощью которого может быть произведена стандартизация рН в неводных растворах, является хлористый водород, так как для него имеются данные о коэффициентах активности в большинстве широко используемых растворителей и в их смесях с водой. Как мы видели ( глава 2), коэффициенты активности НС1 известны в метиловом, этиловом, изопропило-вом, бутиловом, изобутиловом, изоамиловом и бензиловом спиртах, в уксусной кислоте, формамиде, смесях метилового и этилового спиртов с водой, в смесях ацетона и диоксана с водой и в некоторых других растворителях. В качестве электрода сравнения при измерениях в неводных растворах может быть использован хлоросеребряный электрод в растворе НС1, который, как показывает обзор литературных данных и наши исследования, вполне пригоден для измерений в целом ряде чистых неводных растворителей и их смесях с водой. [14]
Однако в этом случае возникает ряд затруднений. Например, коэффициенты активности сильных кислот значительно больше отличаются от единицы, чем в водных растворах; сильные в воде кислоты становятся в неводных растворах слабыми; хуже растворимы соли; значительно меньше имеется данных о коэффициентах активности. В настоящее время единственным веществом, с помощью которого может быть произведена стандартизация рН в неводных растворах, является хлористый водород, так как для него имеются данные о коэффициентах активности в большинстве широко используемых растворителей и в их смесях с водой. В качестве электрода сравнения при измерениях в неводных растворах может быть использован хлорсеребряный электрод в растворе НС1, который вполне пригоден для измерений в ряде чистых неводных растворителей и их смесях с водой. [15]
Страницы: 1