Ионизирующий растворитель
Cтраница 3
Сильно сольватирующис и ионизирующие растворители нивелируют силу кислот, а неполярные и малополярные, взаимодействующие с ними на уровне водородных связей - оказывают дифференцирующее действие. В последнем случае различия в силе кислот становятся более существенными. [31]
Жидкий HF - сильный ионизирующий растворитель. В нем хорошо растворяется вода, фториды, сульфаты и нитраты s - элементов I группы, несколько хуже аналогичные соединения s - элементов II группы. [32]
 |
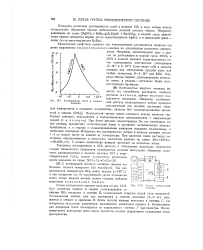
Фрагмент диаграммы состояния системы HF-KF. [33] |
Жидкий HF - сильный ионизирующий растворитель; растворенные в нем электролиты, за исключением хлорной кислоты HCICb, являются основаниями ( см. разд. С водой HF смешивается в любых соотношениях. Раствор, содержащий 35 4 % HF, является аэеотропной смесью. [34]
В среде какого-либо ионизирующего растворителя, например в воде, диссоциация комплексов зависит преимущественно от ионной силы раствора, которая влияет на активность реагирующих веществ ( ср. Экстраполяция экспериментальных результатов к бесконечному разбавлению в чистом растворителе может быть сопряжена с некоторыми трудностями. [35]
Недостатком воды как ионизирующего растворителя для органических соединений является низкая растворимость в ней неионизированных форм этих соединений. За исключением этого ограничения, вода - уникальный эффективный ионизирующий растворитель, что связано прежде всего с ее высокой диэлектрической проницаемостью ( е 80), а также со способностью сольватировать ионы. Чем выше диэлектрическая проницаемость ( полярность) растворителя, тем ниже электростатическая энергия любой пары ионов, находящихся в нем, и, следовательно, тем легче возникают такие пары ионов, тем выше их стабильность в растворе и тем меньше склонность к взаимодействию друг с другом. [36]
Двуокись серы является ионизирующим растворителем, ее можно использовать и без органических растворителей. Однако элемент при этом должен находиться при повышенном давлении, это создает некоторые сложности. Как следует из табл. 4, имеются жидкие окислители, устойчивые при комнатной температуре и являющиеся ионизирующими растворителями. Примерами таких окислителей могут быть оксихлориды. [37]
Амид муравьиной кислоты представляет собой превосходный ионизирующий растворитель, растворимый в воде, низших спиртах и гликолях, но нерастворимый в углеводородах, хлоругле-водородах и в нитробензоле. Он растворяет казеин, желатину, зеин, животный клей и аналогичные растворимые в воде клеи и смолы. В формамиде растворимы хлориды и некоторые сульфаты, а также нитраты меди, свинца, цинка, олова, никеля, кобальта, железа, алюминия и магния. ТУПС [1878] показал, что драйерит не может быть использован в качестве осушителя, ПОСКОЛЬКУ он растворим в формамиде и раствор при стоянии в течение ночи становится коллоидным. [38]
 |
Растворимость NaCl в жидком аммиаке. [39] |
Характерным свойством аммиака как ионизирующего растворителя является его резко выраженное выравнивающее влияние на диссоциацию различных электролитов. Хлориды обычно бывают диссоциированы несколько менее, а иодиды - несколько более соответствующих бромидов. [40]
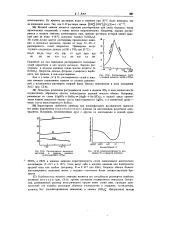 |
Растворимость NaCl в жидком аммиаке ( г / 100 г МН3.| Растворимость щелочных.| Электропроводность растворов Na в жидком аммиаке. [41] |
Характерным свойством аммиака как ионизирующего растворителя является его резко выраженное выравнивающее влияние на диссоциацию различных электролитов. [42]
С) и является хорошим ионизирующим растворителем для ряда солей. [43]
Жидкий фторид водорода является уникальным ионизирующим растворителем. Он практически не проявляет окислительных и восстановительных способностей. В отличие от других галогеноводо-родов HF не окисляется ни одним из известных окислителей до элементного фтора, поэтому его можно применять для приготовления растворов любых окислителей и в его среде успешно проводить титрование по редокс-методу. [44]
Окислительно-восстановительные реакции в - ионизирующем растворителе, состоящие только в переходе электронов от одного простого иона к другому, являются обратимыми и практически протекают мгновенно. С другой стороны, реакции, сопровождающиеся молекулярными перегруппировками, могут идти очень медленно или совсем не идти, даже если термодинамически они возможны. [45]
Страницы: 1 2 3 4