Значение - константа - диссоциация - кислота
Cтраница 1
Значения констант диссоциации кислот и оснований в данной среде, так как сила кислоты или основания в любом растворителе ( НМ) характеризуется константой диссоциации КНАП или / Св или их показателями Р / ( НАП и р / Св - Указанные величины позволяют с большой точностью решать вопрос о нивелирующе-дифференцирующем действии растворителя в отношении данной смеси электролитов. [1]
Значения констант диссоциации кислот и оснований, зависящие от физико-химических свойств растворителей, также определяют выбор растворителя. [2]
Значение констант диссоциации кислот и оснований состоит в том, что они отражают сравнительную силу кислот и осно - ваний в данном растворителе. [3]
Значения констант диссоциации кислот и оснований в данной среде, так как сила кислоты или основания в любом растворителе ( НМ) характеризуется константой диссоциации КНА. [4]
Значения констант диссоциации кислот и оснований, зависящие от физико-химических свойств растворителей, также определяют выбор растворителя. Избираемый растворитель должен обеспечивать наилучшие соотношения констант автопротолиза и констант диссоциации титруемых электролитов. Так, при увеличении Ks константа диссоциации кислоты ( или основания), в данной среде КНАП ( или / Св) должна увеличиваться в большей степени, чем константа автопротолиза; при уменьшении Ks значение ДНАП ( или / Св) не должно увеличиваться; КНАП - ( или КНАП, и) и / Сндп ( или КНАП, i), KB, и и KBI должны по возможности больше отличаться друг от друга. [5]
Значения констант диссоциации кислоты и основания позволяют предполагать, что [ Н 0 1 будет значительно меньше общей концентрации кислоты, а [ ОН - ] будет меньше общей концентрации основания. [6]
Следовательно, концентрация ионов водорода и рН в таких растворах зависит от значения константы диссоциации кислоты и от значения отношения концентрации кислоты к концентрации соли. Повышение концентрации кислоты повышает концентрацию ионов водорода в растворе, а увеличение концентрации соли уменьшает ее. [7]
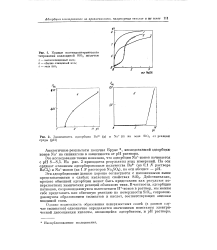 |
Кривые потенциометрического титрования коллоидной SiO2 щелочью.| Зависимость адсорбции Ва2 ( а и Na ( б на золе Si02 от реакции среды ( рН. [8] |
Однако возможность образования поверхностных солей ( в данном случае силикатов) однозначно определяется значениями константы электрической диссоциации кислоты, являющейся адсорбентом, и рН раствора. [9]
Белл пришел к выводу, что уравнение Бренстеда применимо к реакциям, протекающим в бензоле и хлорбензоле и катализируемым кислотами, даже если воспользоваться значениями констант диссоциации кислот в воде. [10]
Уравнение связи между В справочные таблицы включены значения констант кислотой и сопряженным диссоциации Кь для таких оснований, как амины, с ней основанием а другие таблицы содержат значения констант диссоциации кислот ( Ка), сопряженных с этими основаниями. [11]
Отсюда ясно, что буфер должен быть наиболее эффективным при [ НВ ] В - ], так как в этом случае раствор будет одинаково устойчивым и при добавлении кислоты, и при добавлении щелочи. Поэтому для подбора буферной системы в желаемом интервале рН необходимо обратиться к таблицам значений констант диссоциации кислот и выбрать затем такую систему, для которой pH - pA a, где р / ( а - log Д а. Так, например, смесь уксусная кислота - ацетат действует как буфер в пределах 3 7рН5 7, а смесь аммиак - ион аммония - в пределах 8 3рН10 3, причем, когда рН достигает предельных значений, оба раствора теряют буферные свойства. Область максимальной эффективности буферной смеси не зависит от концентрации составляющих ее компонентов. От них зависит, однако, емкость буфера, причем для каждой данной суммарной концентрации компонентов наибольшая емкость будет при рН р / ( а. [12]
Решение задачи нахождения концентрации свободного аниона упростится, как только будет разработан широкий набор мембранных электродов с анионными функциями. В этом направлении интенсивно ведутся исследования и достигнуты определенные успехи [ 3, дополн. Концентрация свободного аниона, в том числе иона гидроксила, может быть вычислена с помощью экспериментальной величины рН, если значение константы диссоциации кислоты в условиях опыта известно. [13]
Такой график имеет смысл в случае амфипротного растворителя. Следует обратить внимание на то, что в качестве примеров растворителей с только основными или только кислотными свойствами мы приводили выше воду или аммиак. Конечно, мы допускали при этом некоторое упрощение, намеренно не обращая внимания на противоположные свойства растворителя. Шкалы кислотности ( или основности) являются для данного растворителя шкалами рН, если мы будем понимать рН как отрицательный логарифм концентрации сольватированного протона Исходя из значений константы диссоциации кислот и принимая, что концентрации кислоты и сопряженного с ней основания равны между собой, мы получаем шкалу, на которой значения рК соответствуют значениям рН для данного растворителя. В случае апротонного растворителя эта шкала не ограничена ни с одной из сторон; когда появляются донорные или акцепторные свойства, шкала становится ограниченной с одной стороны, а если мы рассматриваем амфипротный растворитель, то имеет место двухстороннее ограничение шкалы. Длина шкалы в последнем случае соответствует значению рК, следующему из ионного произведения растворителя. [14]
Страницы: 1