Значение - константа - кислотная диссоциация
Cтраница 1
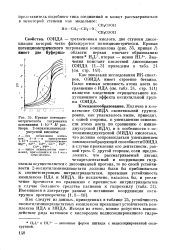 |
Кривые потенцио-метрического титрования основанием 1 - 10 - 3 At раствора 2-оксиэтилпмпнодп-уксусной кислоты. [1] |
Значения констант кислотной диссоциации ОЭИДА [1-3] приведены в табл. 24 ( см. стр. [2]
Сопоставляя значения констант кислотной диссоциации замещенных фенолов ( табл. 43), можно предположить, что сульфониевая группа, у которой при атоме серы имеются объемистые заместители, располагается не копланарно. В случае хлорида трис ( 2-метил - 4-оксифенил) сульфония ( пример 13) в орго-положении находится метильная группа, что делает невозможным свободное вращение бензольных циклов и их нахождение в одной плоскости. [3]
В табл. 2 - 1 приведены значения константы кислотной диссоциации некоторых гидроокисей металлов. На основе этих данных, которые расположены в порядке уменьшения величины константы, можно принять за граничное значение рКа 16; ниже этого значения гидроокись металла практически амфотерна. [4]
 |
График зависимости рН раствора уксусной кислоты от ее концентрации. [5] |
Несколько по-иному представляются зависимости, когда значение константы кислотной диссоциации всегда намного меньше концентрации ионов водорода. В более концентрированных растворах значение степени диссоциации HCN очень мало и можно пренебречь концентрацией аниона по сравнению с общей концентрацией кислоты. [6]
Чаще всего в качестве доказательства уменьшения силы кислоты по мере увеличения отрицательного заряда приводят сильно уменьшающиеся значения очередных констант кислотной диссоциации многопротонных кислот. В ряду Н3РО4 - Н2РО - НРОд - - РО - при последовательной потере протонов сила кислот уменьшается и увеличивается сила сопряженных оснований. [7]
Приведенные примеры показывают, что причисление соединения к категории амфотерных основывается на двух предпосылках. Первая из них, объективная, - это значение константы кислотной диссоциации гидроокиси. Другая предпосылка носит субъективный характер и зависит от концентраций, которыми мы пользуемся, и от масштабов измерений. Когда мы переходим к ечень разбавленным растворам ( например, к концентрациям КЗ 4 - 10 - Б М), тогда мы получаем право трактовать как амфотерные больше веществ. [8]
Константа диссоциации кислоты, растворенной в определенном растворителе, характеризует способность этой кислоты к передаче протона по сравнению с соответствующей способностью молекулы растворителя. Если мы расположим различные вещества, способные отдавать протоны в водном растворе, в порядке уменьшающихся значений констант кислотной диссоциации, то получим ряд кислот с постепенно уменьшающейся силой. На одном конце этого ряда будут находиться вещества, которые с максимальной легкостью отдают протоны в водной среде, а на другом конце - такие вещества, которые являются самыми слабыми кислотами, но все же диссоциируют в водном растворе в степени, поддающейся измерению. [9]
При экстракции диалкилфосфорными, моноалкилфосфорными кислотами и алкилмеркаптанами разветвление в алкильном радикале снижает D % в случае ДАФК - на порядок, а в случае МАФК и алкилмеркаптана - соответственно на 3 - 4 порядка. Значения логарифма констант экстракции Bi ДАФК ( Ig / Bi) при использовании в качестве разбавителя октана равны для Д2ЭГФК 3 40, ДБФК 4 05, ДАФК 4 28, ДГФК4 37, ДОФК4 49, ДДФК4 49, т.е. возрастают с уменьшением значений констант кислотной диссоциации и повышением донорных свойств фосфорильного кислорода бидентантной РО ( ОН) группы. [10]
Однако то, что образуется пурпуреохлорид, является, несомненно, ошибочным представлением. Лишь гидроксопентаммин-комплекс является устойчивым тгентамминовым комплексом [ если равновесие устанавливается в аммиачном растворе, это видно из значений константы кислотной диссоциации розео-иона ( см. стр. R котором лутео - и гидроксопентаммин-комплексы являются единственными комплексами кобальта, присутствующими в растворах в значительных концентрациях. [11]
Однако то, что образуется пурпуреохлорид, является, несомненно, ошибочным представлением. Лишь гидроксопентаммин-комплекс является устойчивым пентамминовым комплексом [ если равновесие устанавливается в аммиачном растворе, это видно из значений константы кислотной диссоциации розео-иона ( см. стр. [12]
Оба рассмотренных примера представляют собой предельные ситуации. Промежуточную электроотрицательность проявляют многие элементы. Ни одна из двух противоположных тенденций в них не выражена ясно; в присутствии сильных доноров протонов соединения этих элементов подвергаются основной диссоциации, а в присутствии сильных акцепторов - кислотной диссоциации. Существенным фактором здесь является значение константы кислотной диссоциации гидроокиси металла. [13]
Страницы: 1