Значение - константа - скорость - реакция
Cтраница 3
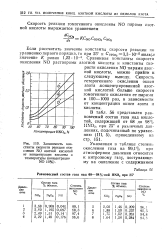 |
Зависимость константы скорости реакции окисления NO азотной кислотой от концентрации кислоты и температуры ( концентрация N0 10 %. [31] |
Если рассчитать значение константы скорости реакции по уравнению первого порядка, то при 25е и CHN03 3 3 10 - 5 моль / л значение К равно 1 22 - Ю-3. [32]
Ниже приведены значения констант скорости реакции ( размерность смь / г-мол сек. [33]
Следовательно, значения констант скоростей реакции конденсации образующихся при гидролизе со-аминокислот и реакции катализированного гидролиза амидной связи в полимерной молекуле отличаются также незначительно. Отличие в значениях глубины превращения мономера в полимер в момент достижения максимальной скорости связано, по-видимому, только с различием констант скоростей роста цепи. [34]
Найденные экспериментально значения констант скоростей реакции алкилирования 2-винилпиридина галоидметиленпроизводными ТФС при различных температурах облегчили подбор оптимальных условий получения полиэлектролита. Следует отметить, что трехмерный полимер не удалось получить с использованием иодметилированной ТФС. По-видимому, в процессе алкилирования часть ионов иода окисляется, а образующийся J2 дезактивирует двойные связи. [35]
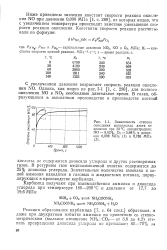 |
Зависимость степени окисления монооксида азота от времени при 30 С, концентрациях NO - 9 92 %, О2 - 5 68 % и давлении 0 098 МПа ( / и 0 785 МПа ( 2. [36] |
Ниже приведены значения констант скорости реакции окисления NO при давлении 0 098 МПа [ 1, с. [37]
В последнем случае значение константы скорости реакции ниже, чем для re - крезола; очевидно, присутствие треиг-бутильных заместителей в орто-положении уменьшает реакционную способность фенола. Эффективность фенолов ( см. табл. 2) повышалась до 2 4-диметил - 6-треяг-бутилфенола и лишь немного уменьшалась для 2 6-ди-тпрет - бутил-4 - метилфенола. Итак, о-игрет-бутильные заместители, стабилизирующие феноксильный радикал, определенным образом затрудняют подвижность атома водорода ОН-группы. [38]
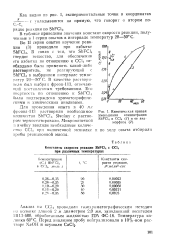 |
Кинетическая кривая уменьшения концентрации SbFCU в ССЦ ( / и ее анаморфоза ( 2. [39] |
В таблице приведены значения констант скорости реакции, полученные в I серии опытов в интервале температур 20 - 50 С. [40]
Вычисляются или отыскиваются значения констант скоростей реакций k, ki и из при температуре процесса. [41]
Вычисляются или отыскиваются значения констант скоростей реакции k, и fe3 при температуре процесса. [42]
Вычисляются или отыскиваются значения констант скоростей реакции k, kz и ks в пределах тех температур, при которых предполагается проведение процесса. [43]
Вычисляются или отыскиваются значения констант скоростей реакций ki, kz, k3 в пределах тех температур, при которых проводится процесс. [44]
Как графически определить значение константы скорости реакции 2-го порядка при равных исходных концентрациях реагирующих веществ. [45]
Страницы: 1 2 3 4 5