Значение - константа - устойчивость - комплекс
Cтраница 1
Значения констант устойчивости комплексов, образованных в водном растворе ионами данного металла с определенными ли-гандами, весьма важны в аналитической химии. Существенны также различия в значениях констант устойчивости комплексов тех же лигандов с другими металлами, так как они характеризуют содержание мешающего вещества, которое может присутствовать при использовании соответствующих аналитических методов. [1]
Для ответа на первый вопрос оценку проводят, исходя из значений констант устойчивости комплексов: в первую очередь образуется более устойчивый комплекс. [2]
Из данных полярографического обследования и из приводимых в табл. 3 и 5 значений констант устойчивости комплексов о-оксифенилиминодиуксусной и фенилиминодиуксусной кислот с различными катионами следует, что несмотря на практически одинаковую основность азота этих соединений, наиболее сильным комплексообразователем является орто-изомер оксифенилиминодиуксусной кислоты. [3]
Чем более прочен комплекс, тем больше образуется окрашенных частиц XRi и тем больше значение константы устойчивости комплекса. [4]
Интересно сравнить произведения растворимости: AgCl ( 1 7 - ID 10), AgBr ( 5 - Ю-13), Agl ( 8ЫО-17), Ag2S ( S-IO 51) со значениями констант устойчивости комплексов серебра. [5]
Значения констант устойчивости комплексов серебра с аминами одинакового структурного типа в одном и том же растворителе линейно возрастают с величиной показателя константы диссоциации лиганда. [6]
Благодаря различию в значениях констант устойчивости комплексов активность свободных катионов уменьшается не одинаково, что обусловливает разницу в степени смещения зон осаждения в отрицательную область. [7]
Значения констант устойчивости комплексов, образованных в водном растворе ионами данного металла с определенными ли-гандами, весьма важны в аналитической химии. Существенны также различия в значениях констант устойчивости комплексов тех же лигандов с другими металлами, так как они характеризуют содержание мешающего вещества, которое может присутствовать при использовании соответствующих аналитических методов. [8]
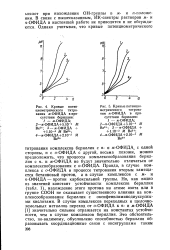 |
Кривые потенциометрического титрования л - ОФИДА в присутствии бериллия.| Кривые потенциометрического титрования л - ОФИДА в присутствии бериллия. [9] |
ОФИДА, с одной стороны, и с о - ОФИДА с другой, весьма похожи, можно предположить, что процессы комплексообразования бериллия с п - и ж - ОФИДА не будут значительно отличаться от комплексообразования с о - ОФИДА. Правда, в случае комплекса с о - ОФИДА в процессе титрования вторым замещается бетаиновый протон, а в случае комплексов с м - и и - ОФИДА - протон карбоксильной группы. Но, как видно из значений констант устойчивости комплексов бериллия ( табл. 1), нахождение этого протона на атоме азота или в группе СООН не оказывает существенного влияния на ком-плексообразование бериллия с оксифенилиминодиуксусны-ми кислотами. В случае комплексов переходных и щелочноземельных металлов переход от о - ОФИДА к п - и л - ОФИДА [1] значительно сильнее отражается на константах устойчивости, чем в случае комплексов бериллия. [10]
Титрование с эриохромом черным Т проводят при рН 8 - 9 в кипящем растворе, содержащем тартрат-ионы; рН раствора не должен быть выше 9, так как иначе комплексы индикатора с металлами оказываются настолько прочными, что не разрушаются под действием ЭДТА. Прибавление тартрат-ионов необходимо для предотвращения выпадения гидроокисей металлов, а кипячение ускоряет реакцию. Основываясь на аналогии в химическом поведении и на сравнительной близости значений констант устойчивости комплексов редкоземельных металлов, можно предсказать, что и другие представители этой группы металлов будут вести себя аналогично. Действительно, практически все трехвалентные ионы редкоземельных металлов, за исключением прометия, можно титровать комплексонометрически. Определениям мешает CeIV, но его можно легко восстановить аскорбиновой кислотой. [11]
Таким образом, маскирование при помощи комплексообразующего реагента связано с тем, что добавляемый комплексующий реагент; связывает мешающий ион в соединение более прочное, чем соединение с применяемым реагентом, в то время - как определяемый ион с этим реагентом не взаимодействует. Однако чаще всего в реакцию вступает как маскируемый ион, так и определяемый. В этом случае необходимо следить, чтобы связывание определяемого иона не приводило к понижению его концентрации ниже предела обнаружения. Как видно из приведенного выше примера, иногда можно теоретически рассчитать процесс маскирования комплексообразующими реагентами. Для таких расчетов очень важны значения констант устойчивости комплексов и приведенные в разд. [12]
Страницы: 1