Значение - константа - гидролиз
Cтраница 1
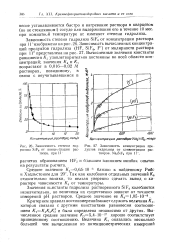 |
Зависимость степени гид - [ IMAGE ], Зависимость концентрации гтро-ролиза SiF6 от концентрации рас - дуктов гидролиза от концентрации раствора, при И - творов. Na2SiF6 при 11. [1] |
Значения константы гидролиза растворенного SiF4 колеблются незначительно, но величины их существенно зависят от точности измерений рН растворов. [2]
Значения константы гидролиза К были выведены для парциальных давлений хлора ниже 1 атм. [3]
Значения константы гидролиза K 0i, найденные при различных температурах из данных, спектро-фотометрических измерений, приведены в Приложении ( стр. Они находятся в удовлетворительном согласии со значениями константы, полученными из потенциометрических данных. [4]
Сопоставление значений констант гидролиза показывает, что второй ступенью гидролиза, выражаемой уравнениями ( 3) и ( 5), можно пренебречь. [5]
В таблице приведены также значения констант гидролиза, вычисленные по этим данным для диаммонийфосфата и ацетата аммония. [6]
Гидролиз U4 сильно зависит от температуры, что видно из табл. 14, где представлены значения константы гидролиза К. [7]
В табл. 11 приведены значения констант диссоциации некоторых многоосновных кислот и подсчитанные с их помощью значения констант гидролиза. [8]
Последнее расхождение, вероятно, связано с различием в степени диссоциации H2SO4 и D2SO4 и в значениях констант гидролиза нептуния в тяжелой и обычной воде. [9]
Для кварцевого стекла 6 0 7 мл / мкг ( как и для кварца), но значение константы гидролиза К оказалось много большим, чем для кварца, что указывает на гораздо большую скорость гидролиза кварцевого стекла по сравнению с кварцем. [10]
После установления равновесия измеряли рН и оптическую плотность раствора при макс - Характер зависимости оптической плотности от рН позволяет оценить значение константы гидролиза красителя графическим путем. На рис. 1 в качестве примера приведена такая зависимость для астразона красно-фиолетового, на основании которой можно предположить, что при рН 11 - 12 краситель полностью находится в молекулярной ОН-форме. [11]
Полученные значения рН рекомендуется использовать для расчета констант гидролиза исследуемой соли. Студенты должны усвоить как связаны между собой степень гидролиза, константа гидролиза, водородный показатель и уметь оценивать достоверность значений констант гидролиза, найденных из экспериментальных результатов, сравнивая их с константами гидролиза, рассчитанными из справочных данных. [12]
Поэтому нами эта величина не приводится. В табл. 1.1 также не приведены результаты расчета стандартных потенциалов для системы TiIV / Tini из работы [41] из-за расхождения в значениях констант гидролиза ионов Tiiv. Сопоставление значений этих констант дано в работе [130], но до сих пор отсутствует единое мнение ( ср. Причина отклонения от этих данных, как и расхождения результатов между собой в работах [44, 122] ( табл. 1.2), пока не ясна. Эффект лиганда в работах [41, 43], как причину рассматриваемого расхождения в величинах формального потенциала, следует исключить, так как данные [41, 43] экстраполированы к нулевой концентрации лиганда. Аномалия ( сильно отрицательное значение) E - fTI iv / Tii из работы [121] ( табл, 1.2) объяснена ниже. [13]
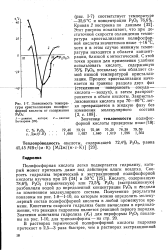 |
Зависимость температуры кристаллизации полифос-фррной кислоты от содержания Р265. [14] |
Полифосфорная кислота легко подвергается гидролизу, который может протекать даже под действием влаги воздуха. Полученные результаты показаны на рис. 1 - 8 - 1 - 10, по которым можно определить молекулярный состав полифос форной кислоты в любой промежуток времени. Константы скорости гидролиза были вычислены в предположении, что реакция гидролиза является реакцией первого порядка. Значения константы гидролиза ( / Сг) для пироформы РзОз показаны на рис. 1 - 10, для триполиформы - на стр. [15]
Страницы: 1