Расчет - константа
Cтраница 2
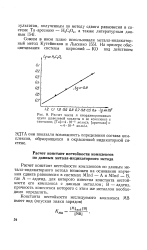
Расчет констант полимеризации К п [ Ме - ] / [ MeJ [ Ме ] в предположении образования цепочечных полимеров показал, что в растворах, содержащих 6 3 моль / л HNO3, с увеличением концентрации гафния Кп довольно быстро уменьшается, а в 2-мол. [16]
 |
Значения Л и а для различных систем. [17] |
Расчет константы Хаггинса по данным измерения приведенной вязкости дает меньшее совпадение. [18]
Расчет константы обмена по уравнению ( 122) возможен при точно известном заряде обменивающихся ионов и полной диссоциации исследуемых электролитов. Если изучаемая система содержит слабые электролиты, гидролизо-ванные или закомплексованные ионы, расчет константы обмена затрудняется или становится невозможным вследствие того, что неизвестны истинная концентрация и величина заряда обменивающихся ионов, особенно в фазе ионита. [19]
Расчеты константы комплексообразования Кс, по Гхошу и Миттеру, могут дать правильную картину относительной прочности комплексов с различными кислотами лишь тогда, когда измерения проводят в области приблизительно полной диссоциации. [20]
 |
Расчет числа п координированных. [21] |
Расчет констант нестойкости комплексов по данным металл-индикаторного метода возможен на основании изучения сдвига равновесия в системах Mind - Аи Mind - В, где А - адденд, для которого известна константа нестойкости его комплекса с данным металлом; В - адденд, прочность комплекса которого с этим же металлом необходимо определить. [22]
Расчет констант кислотной диссоциации групп флуорексона и констант нестойкости, его комплексов с кальцием, стронцием и барием проводился по данным потенциометриче-ского титрования на потенциометре ЛП-58 со стеклянным электродом; электродом сравнения служил каломельный электрод. [23]
Расчетом констант равновесии ш уравнениям ( 29) - ( 34) можно установить, что алкилированпе бензола бутилена ми с термодинамической точки зрения целесообразно проводить при температуре не выше 600 К и атмосферном давлении. Максимальный выход втор-бутнлбензола - 0 56 жоль на моль G Hg при алкилировании бензола н-бутнлеиом на алюмо-силикатном катализаторе получен при 250 С, давлении 40 5 бар и у2 5: I [98], а на чардахлннекой глине при 350 С. [24]
Такой расчет констант является вообще довольно трудоемким, поэтому чаще пользуются приближенными методами. [25]
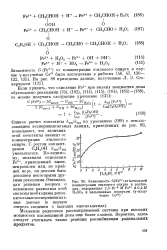 |
Зависимость G ( Fe3 от начальной концентрации этилового спирта в растворах, содержащих 2 5 - 10 - 4 М Fe2 иО 4М и насыщенных воздухом ( у - излучение Со60. [26] |
Однако расчет константы ftloa / A164 по уравнению ( 189) с использованием экспериментальных данных, приведенных на рис. 80, показывает, что величина этой константы зависит от концентрации этилового спирта. С ростом концентрации С2Н5ОН А: 102 / / с161 уменьшается. По-видимому, механизм окисления Fe2, приведенный выше, неправилен или, по крайней мере, он должен быть дополнен некоторыми другими реакциями. [27]
 |
Заселенность электронами МО в нейтральной молекуле, анион - и катион. [28] |
Рассмотрим расчет констант СТВ для анион-радикала нафталина ( АУ), который легко образуется как при электрохимическом восстановлении, так и при восстановлении с помощью щелочных металлов. [29]
 |
Заселенность электронами МО в нейтральной молекуле, анион - и катион-радикале нафталина. [30] |
Страницы: 1 2 3 4