Расчет - растворимость - осадки
Cтраница 1
Расчеты растворимости осадков в кислотах несколько усложняются в связи с тем, что большинство слабых кислот являются в то же время и многоосновными кислотами. Участие в равновесии нескольких ионов водорода осложняет вычисления. [1]
Расчеты растворимости осадков в кислотах несколько усложняются в связи с тем, что большинство слабых кислот являются в то же время и многоосновными кислотами. Участие в равновесии нескольких ионов водорода осложняет вычисления. Многоосновные кислоты диссоциируют ступенчато, поэтому взаимодействие между анионами многоосновных кислот и ионами водорода имеет также ступенчатый характер. В зависимости от концентрации ионов водорода образуются те или другие продукты реакции. [2]
Расчеты растворимости осадков при образовании комплексов связаны с некоторыми затруднениями. Кроме того, комплексные ионы, аналогично многоосновным кислотам, образуются и диссоциируют ступенчато. Состояние равновесия между отдельными формами комплексных групп зависит от концентрации лиганда и кислотности раствора. [3]
Подробно о расчете растворимости осадков в кислотах при различных условиях см. Б а б к о. [4]
Подробно о расчете растворимости осадков в кислотах при различных условиях см. А. К. Ба б к о. [5]
Рассмотрим несколько примеров расчета растворимости осадков при комплексообразовании. [6]
Из приведенных ниже примеров расчета растворимости осадков видно, что применение уравнения (9.17) вместо приближенного уравнения (9.3) вносит лишь небольшие поправки в результаты расчета и в большинстве случаев увеличением растворимости осадков под влиянием введения посторонних электролитов можно пренебречь. Поэтому произведение растворимости является одной из основных характеристик осадка. [7]
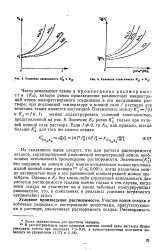 |
Условная зависимость Kg я Ка.| Условная зависимость Kg и Kg. [8] |
Из сказанного выше следует, что для расчета растворимости осадков, характеризуемой равновесной концентрацией ионов, необходимо использовать произведение растворимости. [9]
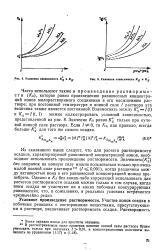 |
Условная зависимость Kg я Ка.| Условная зависимость Kg и Kg. [10] |
Из сказанного выше следует, что для расчета растворимости осадков, характеризуемой равновесной концентрацией ионов, необходимо использовать произведение растворимости. Однако и Ks без каких-либо корреляций использовать для расчетов растворимости осадков можно только в том случае, когда ионы осадка не участвуют ни в каких побочных конкурирующих равновесиях, что, к сожалению, в реальных условиях встречается чрезвычайно редко. [11]
Книга составлена применительно к программе по количественному анализу для химико-технологических институтов. В ней приводятся задачи по вычислениям результатов весового и объемного анализа, расчетам растворимости осадков, электроанализу, колориметрии и газовому анализу. [12]
Книга составлена применительно к программе по количественному анализу для химико-технологических институтов. В ней приводятся задачи по вычислениям результатов весового и объемного анализа, расчетам растворимости осадков, электроанализу, колориметрии и газовому анализу. [13]
Страницы: 1