Расчет - степень - окисление
Cтраница 1
Расчет степени окисления N0 при 200 С для газа, содержащего 9 92 объемн. [1]
Расчет степени окисления NO при 200 С для газа, содержащего 9 92 объемн. [2]
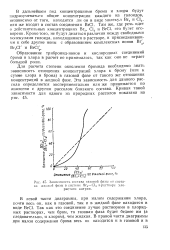 |
Зависимость состава газовой фазы от состава жидкой фазы в системе Br. j - C12 в растворе хлористого натрия. [3] |
Для расчета степени окисления бромида необходимо знать зависимость отношения концентраций хлора к брому ( или к сумме хлора и брома) в газовой фазе от такого же отношения концентраций в жидкой фазе. Эта зависимость для данного рассола определяется экспериментально или же принимается по аналогии с другим рассолом близкого состава. [4]
Для расчета степени окисления газа находят содержание общего и нитритного азота в миллиграммах, соответствующее взятой пробе газа, и определяют их соотношение. [5]
Для расчета степени окисления окиси азота выразим парциальные давления газов, входящие в уравнение равновесия, через общее давление в зависимости от начальной концентрации газа. [6]
Для расчета степени окисления окиси азота выразим парциальные давления р газов, входящих в это уравнение, через общее давление в зависимости от начальной концентрации газа. [7]
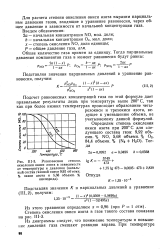 |
Равновесная степень окисления окиси азота в зависимости от температуры и давления ( начальный состав газовой смеси 9 92 объемн. % окиси азота и 5 68 объемн. % кислорода. [8] |
Для расчета степени окисления окиси азота выразим парциальные давления газов, входящие в уравнение равновесия, через общее давление в зависимости от начальной концентрации газа. [9]
Как видно, при расчете степени окисления принимается, что связь С - С не поляризована, что в общем случае неверно и является грубым упрощением - Степень окисления - понятие формальное, не характеризующее истинное электронное состояние атома углерода и не связанное с механизмом химического превращения. Единственное его назначение - расчет стехиометрических отношений химических реакций. Поэтому в органической химии понятием о степени окисления предпочитают не пользоваться. [10]
Как видно, при расчете степени окисления принимается, что связь С-С не поляризована, что в общем случае неверно и является грубым упрощением. Степень окисления - понятие формальное, не характеризующее истинное электронное состояние атома углерода и не связанное с механизмом химического превращения. Единственное его назначение - расчет стехиометрических отношений химических реакций. Поэтому в органической химии понятием о степени окисления предпочитают не пользоваться. [11]
Для соединений, состоящих из трех элементов и более, расчет степеней окисления усложняется. Существенную помощь при определении степеней окисления сложных соединений, а также при составлении эмпирических формул оказывает тот факт, что элементы главных и некоторых побочных подгрупп имеют характерные для них степени окисления, зависящие от номера группы. [12]
Для исследования влияния парметров насадки на проводимый процесс были проведены расчеты степени окисления нафталина при одинаковых гидродинамических условиях ( скорости газа и высоты неподвижного слоя) с различными насадками. [13]
При расчете степени окисления принимают, что при координации лиганды не изменяют своей нормальной заряднос-ти. Например, ион [ Со ( МН3) б ] 8 относят к производным Со3, приписывая NH3 нулевой заряд как нейтральной молекуле, а ион [ Co ( SCN) 4 ] 2 - - к производным Co2 v приписывая группе SCN - заряд. [14]
Степенью окисления называется условный заряд атома в веществе, вычисленный в предположении, что оно состоит из ионов. При расчете степеней окисления исходят из электронсйтральности вещества: сумма степеней окисления всех атомов в соединении равна нулю. [15]
Страницы: 1 2