Расчет - гейтлер
Cтраница 1
Расчет Гейтлера и Лондона дал количественное объяснение химической связи на основе квантовой механики. Он показал, что если электроны атомов водорода обладают противоположно направленными спинами, то при сближении атомов происходит значительное уменьшение энергии системы - возникает химическая связь. Образование химической связи обусловлено тем, что при наличии у электронов антипараллельных спинов становится возможным передвижение электронов около обоих ядер, которое иногда не вполне удачно называют обменом электронов. Движение электронов около обоих ядер приводит к значительному увеличению плотности электронного облака в пространстве между ядрами, которое стягивает положительно заряженные ядра. Следовательно, образование химической связи объясняется понижением потенциальной энергии электронов, обусловленным увеличением плотности электронного облака в пространстве между ядрами. [1]
Расчеты Гейтлера - Лондона ( Heitler - London) показали, что мерой гомеополяр-ной валентности атома во многих случаях служит число так называемых неспаренных электронов. Например, у Не в нормальном состоянии оба электрона спарены ( ср. Литий, наоборот, как и Н, обладает неспаренным электроном; поэтому литий может ( кроме гетерополярных) образовать также гомеополярные соединения. [2]
Расчеты Гейтлера - Лондона ( Heitler - London) показали, что мерой гомеополяр-ной валентности атома во многих случаях служит число так называемых неспаренных электронов. [3]
Расчеты Гейтлера - Лондона ( Heitler - London) показали, что мерой гомеополяр-ной валентности атома во многих случаях служит число так называемых неспаренных электронов. Например, у Не в нормальном состоянии оба электрона спарены ( ср. Так как Не не обладает неспаренными электронами, он столь же мало способен образовывать гомеополярные соединения, как и ( вследствие своего высокого потенциала ионизации) гетерополярные соединения. Литий, наоборот, как и Н, обладает неспаренным электроном; поэтому литий может ( кроме гетерополярных) образовать также гомеополярные соединения. [4]
Расчет Гейтлера и Лондона дал количественное объяснение химической связи на основе квантовой механики. Он показал, что если электроны атомов водорода обладают противоположно направленными спинами, то при сближении атомов происходит зна чительное уменьшение энергии системы - возникает химическая связь. Образование химической связи обусловлено тем, что при наличии у электронов антипараллельных спинов становится возможным передвижение. Движение электронов около обоих ядер приводит к значительному увеличению плот. Следовательно, образование химической связи объясняется понижением потенциальной энергии электронов, обусловленным увеличением плотности электронного облака в пространстве между ядрами. [5]
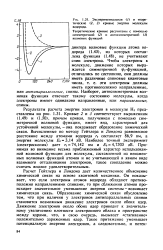 |
Экспериментальная ( / и теоретические ( 2, 3 кривые энергии молекулы водорода. [6] |
Расчет Гейтлера и Лондона дает количественное объяснение химической связи на основе квантовой механики. Он показывает, что если электроны атомов водорода обладают противоположно направленными спинами, то при сближении атомов происходит значительное уменьшение энергии системы - возникает химическая связь. Образование химической связи обусловлено тем, что при наличии у электронов антипараллельных спинов становится возможным движение электронов около обоих ядер. Движение электронов около обоих ядер приводит к значительному увеличению плотности электронного облака в пространстве между ядрами, что, в свою очередь, вызывает стягивание положительно заряженных ядер. [7]
После расчетов Гейтлера - Лондона, показавших, что ковалент-ная связь образуется парой электронов с противоположными спинами, а прочность связи является результатом квантово-механиче-ского взаимодействия, концепция резонанса и ее приложение к органической химии развивались Паулингом и другими 27 28 подкрепляя и распространяя электронные воззрения Робинзона, Ингольда и Арндта. Если возможно предложить для молекулы две или более обоснованные электронные структуры и если при этом соблюдаются известные другие условия, нормальное состояние молекулы не может быть представлено одной изолированной структурой, но должно быть описано всеми этими структурами. [8]
Если в расчетах Гейтлера и Лондона используется волновая функция (1.48), которая описывает движение обоих электронов в молекуле Нг, то метод молекулярных орбиталей исходит из волновых функций отдельных электронов. Таким образом, считается, что каждый электрон в молекуле находится на определенной молекулярной орбитали, описываемой соответствующей волновой функцией. Каждой молекулярной орбитали отвечает определенная энергия. На одной молекулярной орбитали могут находиться два электрона с противоположно направленными спинами. [9]
Если в расчетах Гейтлера и Лондона используется волновая функция (1.48), которая описывает движение обоих электронов в молекуле Н2, то метод молекулярных орбиталей исходит из волновых функций отдельных электронов. Таким образом, считается, что каждый электрон в молекуле находится на определенной молекулярной орбитали, описываемой соответствующей волновой функцией. Каждой молекулярной орбитали отвечает определенная энергия. На одной молекулярной орбитали могут находиться два электрона с противоположно направленными спинами. [10]
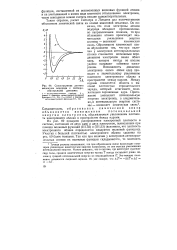 |
Сопоставление расчета молекулы водорода о экспериментальными данными. [11] |
Таким образом, расчет Гейтлера и Лондона дал количественное объяснение химической связи на основе квантовой механики. Он показал, что если электроны атомов водорода обладают противоположно направленными спинами, то при сближении атомов происходит значительное уменьшение энергии системы - возникает химическая связь. Образование химической связи обусловлено тем, что при наличии у электронов антипараллельных спинов становится возможным передвижение электронов около обоих ядер, которое иногда не вполне удачно называют обменом электронов. Возможность движения электронов около обоих ядер приводит к значительному увеличению плотности электронного облака в пространстве между ядрами. Между ядрами появляется область G высокой плотностью отрицательного заряда, который стягивает положительно заряженные ядра. [12]
Таким образом, расчет Гейтлера и Лондона дал количественное объяснение химической связи на основе квантовой механики. [13]
Страницы: 1