Графический расчет - процесс - кристаллизация
Cтраница 1
Графические расчеты процесса кристаллизации NaHCOs выполнены для трех исходных комплексов, обозначенных точками б ( 6), 7 ( Т) и 8 ( 8) по следующей схеме. Положение последних характеризует солевой состав маточных растворов. [1]
Это соотношение применяют и для графического расчета процесса кристаллизации. [2]
Поэтому здесь применимо правило рычага для графического расчета процессов кристаллизации и испарения. [3]
К квадратной диаграмме применимы правила рычага и соединительной прямой для графического расчета процесса кристаллизации. Однако правило рычага неприменимо для определения количества испаряемой воды, так как фигуративная точка воды удалена на водной проекции в бесконечность. Недостатком рассматриваемого типа диаграммы является относительная сложность подсчета весовых количеств испаряемой воды, выделяющейся твердой фазы и маточного раствора. [4]
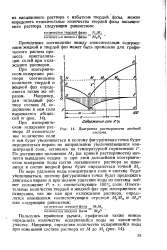 |
Диаграмма растворимости системы. [5] |
Приведенное соотношение между относительным содержанием жидкой и твердой фаз может быть применено для графического расчета процесса кристаллизации солей при охлаждении растворов. [6]
Диаграмма состояния позволяет определить не только число фаз и их состав при различных температурах, но и относительные количества каждой фазы. Графические расчеты процессов кристаллизации, растворения и испарения основаны на использовании правила соединительной прямой и правила рычага. Фигуративная точка системы и фигуративные точки частей, составляющих эту систему, лежат на одной прямой - конноде. Количество двух частей, составляющих систему, обратно пропорциональны длинам отрезков, заключенных между фигуративными точками этих составных частей и фигуративной точкой системы. [7]
В этом случае при графических расчетах процессов кристаллизации, испарения, высаливания, растворения, смешения применимы правила соединительной прямой и рычага, что является весьма важным преимуществом диаграмм этого типа. Кроме того, использование весовых единиц дает возможность избежать лишних расчетов. Следует также отметить возможность точного построения таких диаграмм и графических расчетов с применением обычной миллиметровой бумаги. [8]
 |
Принципы построения изотермических диаграмм растворимости первого типа для трех - и четырехкомпонентных систем. [9] |
Конечное значение на этих диаграммах имеют лишь линии упаривания раствора, а также линии кристаллизации твердых фаз, представленных гидратами. Следовательно, применение правила рычага для графического расчета процессов кристаллизации ( как политермической, так и изотермической) или растворения при построении диаграмм второго типа невозможно в тех случаях, когда кристаллизуются ( или растворяются) безводные соединения. [10]
Проекция луча кристаллизации на плоскостях tx и ty не является прямой линией, так как проходит по кривой поверхности насыщения. Поэтому применение этих политермных проекций для графических расчетов процесса политермной кристаллизации ( растворения) практически неудобно. [11]
Действительно, лучи кристаллизации исходят из бесконечности, так как по общему правилу они должны исходить из точки состава выпадающих твердых фаз. Только фигуративные точки состава гидратов откладывают на координатных осях, используя величины содержания в них воды. Конечное значение имеют только длины лучей испарения раствора и кристаллизации гидратов. Поэтому здесь неприменимо правило рычага для графического расчета процесса кристаллизации. Графический расчет возможен для количества испаряемой воды и при кристаллизации ( растворении) гидратов. [12]
Страницы: 1