Теоретический расчет - константа
Cтраница 1
Теоретический расчет константы ks представляет трудную задачу, которая пока еще не решена полностью. [1]
Задача теоретического расчета констант СТВ в радикалах решается в два этапа: во-первых, квантовохимический, молекулярный расчет, цель которого состоит в нахождении матрицы спиновой плотности, и, во-вторых, расчет изотропного СТВ и компонент тензора анизотропного СТВ с известной матрицей спиновой плотности. [2]
Некоторые попытки теоретического расчета констант равновесия в растворе были связаны с использованием решеточной модели и включали весьма грубые приближения. [3]
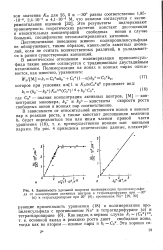 |
Зависимость удельной скорости полимеризации пропиленсудьфи. [4] |
Эти результаты подчеркивают правомерность теоретических расчетов констант диссоциации и относительных концентраций свободных ионов в случае больших, специфически несольватированных катионов. [5]
А / 7 и AZ вычисляют, пользуясь табличными данными термодинамических величин и используют при теоретических расчетах констант равновесия реакций. [6]
Кроме экспериментального определения констант скорости элементарных химических процессов в ИХФ в лаборатории Е. Е. Никитина проводились и проводятся также теоретические расчеты констант. С 1959 г. были рассчитаны константы скорости диссоциации молекул хлора, брома и иода в атмосфере инертного газа, распада молекул 03, NO2C1, H202, H204, N2H4, константы скорости процессов 02 - - Аг 20 - - Аг и 03 О 30, N20 М N2 О М и N20 N. Изучалась также динамика гарпунных реакций Me - - Х2 МеХ - - X с определением сечений ( Me - атом щелочного металла, X - галоген) и распределения энергии в продуктах. [7]
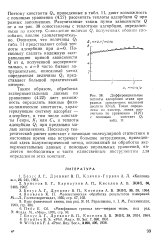 |
Дифференциальные теплоты адсорбции этана при разных заполнениях полостей цеолита KNaX. Точки определены из изостер, линия рассчитана по уравнению с помощью констант Qi. [8] |
Таким образом, обработка экспериментальных данных по уравнению (4.22) дает возможность определить важные физико-химические константы, характеризующие систему адсорбат - адсорбент, в том числе константы Генри, Ki или Ci, и теплоты адсорбции Qi при предельно малых заполнениях. Поскольку теоретический расчет констант с помощью молекулярной статистики в настоящее время еще встречает большие затруднения, приведенный здесь полуэмпирический метод, основанный на обработке экспериментальных данных с помощью вириальных уравнений, является необходимым и часто единственным инструментом для определения этих констант. [9]
Считая раствор смесью мономеров и ассоциатов, взаимодействия между которыми носят чисто ван-дер-ваальсовый характер, мы можем формально исключить сильные взаимодействия из числа рассматриваемых межмолекулярных взаимодействий. Энергетические и энтропийные характеристики образования ассоциатов, связанные с изменением статистических сумм молекул в процессе ассоциации, неявно учитываются через константу равновесия процесса. Эти характеристики определяют равновесные соотношения между количествами ассоциатов разного типа в растворе; оценка их необходима для теоретического расчета констант равновесия. Однако в подавляющей части работ не ставится задача теоретического расчета констант равновесия; величины констант вводятся в термодинамические уравнения как параметры и определяются на основании экспериментальных данных. [10]
На рис. V.17 представлена зависимость концентрации НС1 в полиэтилене как функция концентрации соляной кислоты и как функция давления паров НС1 над кислотой. Из рис. V.17 видно, что концентрация НС1 в полимере быстро возрастает с увеличением концентрации соляной кислоты. При сорбции из сухой газовой фазы выполняется закон Генри. Теоретический расчет константы Генри для системы НС1 - полиэтилен, выполненный по методике, описанной в [154], дал значение 10 - 8 г / ( г. Па), близкое к найденному экспериментально. [11]
При изотопном уравновешивании отношения концентраций водорода и дейтерия в газообразной фазе над металлом и растворенных в металле, вообще говоря, не одинаковы. Распределение изотопов между двумя фазами зависит как от их молекулярных и атомных констант, так и от экспериментальных условий - в первую очередь от температуры. Зная константу равновесия обменной реакции, всегда можно по известным концентрациям изотопов в газовой фазе вычислить отношение полного числа атомов водорода к полному числу атомов дейтерия и, зная далее полное число атомов дейтерия, первоначально введенное в обменник, можно определить интересующее нас полное число атомов водорода, первоначально находившееся в навеске металла. Однако теоретический расчет константы равновесия или ее экспериментальное определение представляют сложную задачу. [12]
Теоретическое решение первых двух задач, требующее оценки энергии образования и статистических сумм ассоциатов, представляет чрезвычайно трудную проблему даже применительно к газам. Для растворов задача еще более усложняется вследствие необходимости учета ряда дополнительных факторов: взаимодействия молекулярного комплекса с окружением, заторможенности вращения молекулы как целого, зависимости энергии связи и сумм по внутренним состояниям ассоциата от характера окружения. Трудности теоретического решения проблемы объясняют тот факт, что суждения о характере образующихся в растворе ассоциатов в настоящее время целиком основаны на экспериментальных ( главным образом, спектральных) данных. Немногие попытки теоретического расчета констант равновесия в растворе были связаны с использованием решеточной модели и включали весьма грубые приближения. [13]
Считая раствор смесью мономеров и ассоциатов, взаимодействия между которыми носят чисто ван-дер-ваальсовый характер, мы можем формально исключить сильные взаимодействия из числа рассматриваемых межмолекулярных взаимодействий. Энергетические и энтропийные характеристики образования ассоциатов, связанные с изменением статистических сумм молекул в процессе ассоциации, неявно учитываются через константу равновесия процесса. Эти характеристики определяют равновесные соотношения между количествами ассоциатов разного типа в растворе; оценка их необходима для теоретического расчета констант равновесия. Однако в подавляющей части работ не ставится задача теоретического расчета констант равновесия; величины констант вводятся в термодинамические уравнения как параметры и определяются на основании экспериментальных данных. [14]
Страницы: 1