Теоретический расчет - коэффициент - активность
Cтраница 1
Теоретические расчеты коэффициентов активности основаны на представлениях, которые раскрывают природу сил, вызывающих отклонение свойств реальных растворов от свойств идеальных. Для расчета коэффициентов активности ионов используется теория Дебая - Хюккеля. По этой теории ион в растворе рассматривается как заряженная частица, окруженная ионной атмосферой преимущественно из противоположно заряженных ионов, а взаимодействие иона с ионной атмосферой имеет электростатический ( кулоновский) характер. [1]
В настоящее время теоретический расчет коэффициентов активности возможен только для очень разбавленных растворов, где преобладает наиболее простой тип электростатического взаимодействия между ионами. Для концентрированных растворов, имеющих концентрации, используемые на практике, определение коэффициентов активности производится экспериментально. [2]
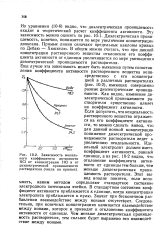 |
Зависимость моляль-ного коэффициента активности НС1 от концентрации НС1 и от диэлектрической проницаемости растворителя ( числа на кривых. [3] |
Из уравнения ( 10 - 6) видно, что диэлектрическая проницаемость входит в теоретический расчет коэффициента активности. Диэлектрическая проницаемость, конечно, понижается по мере увеличения концентрации диоксана. Прямые линии означают предельные наклоны кривых по Дебаю - Хюккелю. В общем можно считать, что при данной концентрации растворенного вещества отклонение его коэффициента активности от единицы увеличивается по мере уменьшения диэлектрической проницаемости растворителя. Еще лучше эта зависимость может быть выявлена путем сопоставления коэффициента активности растворенного вещества непосредственно с его концентрацией в различных растворителях ( рис. 10 - 2), имеющих совершенно разные диэлектрические проницаемости. Как видно, изменение диэлектрической проницаемости растворителя существенно влияет на коэффициент активности. Если допустить, что неидеальность растворенного вещества отражается на его коэффициенте активности, то можно сделать вывод, что для данной ионной концентрации понижение диэлектрической проницаемости растворителя ведет к увеличению неидеальности. Идеальный электролит должен иметь коэффициент активности, равный единице, а из рис. 10 - 2 видно, что отклонение коэффициента активности от единицы тем больше, чем меньше диэлектрическая проницаемость растворителя. Этот вывод вполне понятен, если вспомнить, каким методом определяют стандартное состояние электродного потенциала ячейки. В стандартном состоянии коэффициент активности приближается к единице, когда концентрация электролита приближается к нулю. Значит при бесконечном разбавлении взаимодействие между ионами отсутствует. Следовательно, при конечных концентрациях начинается взаимодействие между ионами, которое и приводит к отклонению коэффициента активности от единицы. Чем меньше диэлектрическая проницаемость растворителя, тем сильнее будет выражено это взаимодействие между ионами. [4]
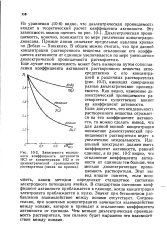 |
Зависимость моляль-ного коэффициента активности НС1 от концентрации НС1 и от диэлектрической проницаемости растворителя ( числа на кривых. [5] |
Из уравнения ( 10 - 6) видно, что диэлектрическая проницаемость входит в теоретический расчет коэффициента активности. Диэлектрическая проницаемость, конечно, понижается по мере увеличения концентрации диоксана. Прямые линии означают предельные наклоны кривых по Дебаю - Хюккелю. В общем можно считать, что при данной концентрации растворенного вещества отклонение его коэффициента активности от единицы увеличивается по мере уменьшения диэлектрической проницаемости растворителя. Еще лучше эта зависимость может быть выявлена путем сопоставления коэффициента активности растворенного вещества непосредственно с его концентрацией в различных растворителях ( рис. 10 - 2), имеющих совершенно разные диэлектрические проницаемости. Как видно, изменение диэлектрической проницаемости ра створителя существенно влияет на коэффициент активности. Если допустить, что неидеальность растворенного вещества отражается на его коэффициенте активности, то можно сделать вывод, что для данной ионной концентрации понижение диэлектрической проницаемости растворителя ведет к увеличению неидеальности. Иде альный электролит должен иметь коэффициент активности, равный единице, а из рис. 10 - 2 видно, что отклонение коэффициента активности от единицы тем больше, чем меньше диэлектрическая проницаемость растворителя. Этот вывод вполне понятен, если вспомнить, каким методом определяют стандартное состояние электродного потенциала ячейки. В стандартном состоянии коэффициент активности приближается к единице, когда концентрация электролита приближается к нулю. Значит при бесконечном разбавлении взаимодействие между ионами отсутствует. Следовательно, при конечных концентрациях начинается взаимодействие между ионами, которое и приводит к отклонению коэффициента активности от единицы. Чем меньше диэлектрическая проницаемость растворителя, тем сильнее будет выражено это взаимодействие между ионами. [6]
Из уравнения ( 10 - 6) видно, что диэлектрическая проницаемость входит в теоретический расчет коэффициента активности. Диэлектрическая проницаемость, конечно, понижается по мере увеличения концентрации диоксана. Прямые линии означают предельные наклоны кривых по Дебаю - Хюккелю. В общем можно считать, что при данной концентрации растворенного вещества отклонение его коэффициента активности от единицы увеличивается по мере уменьшения диэлектрической проницаемости растворителя. Еще лучше эта зависимость может быть выявлена путем сопостав ления коэффициента активности растворенного вещества непосредственно с его концентра цией в различных растворителях ( рис. 10 - 2), имеющих совершенно разные диэлектрические проницаемости. Как видно, изменение ди электрической проницаемости ра створителя существенно влияет на коэффициент активности. Если допустить, что неидеальноеп: растворенного вещества отражает ся на его коэффициенте активно сти, то можно сделать вывод, что для данной ионной концентрации-понижение диэлектрической проницаемости растворителя ведет к увеличению неидеальности. [7]
В связи с этим большое значение может иметь попытка количественного расчета изотерм экстракции на основании теоретического расчета коэффициентов активности и констант равновесия химической реакции взаимодействия экстрагируемого вещества с экстр а ген том или реагентом, находящимся в органической фазе. [8]
Из уравнения ( 12 - 6) видно, что диэлектрическая проницаемость входит в выражение для теоретического расчета коэффициента активности. Диэлектрическая проницаемость, конечно, понижается по мере увеличения концентрации диоксана. Прямые линии означают предельные наклоны кривых по Дебаю - Хюккелю. [9]
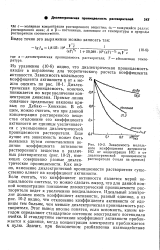 |
Зависимость моляльного коэффициента активности НС1 от концентрации НС1 и от. [10] |
Из уравнения ( 10 - 6) видно, что диэлектрическая проницаемость входит в выражение для теоретического расчета коэффициента активности. Диэлектрическая проницаемость, конечно, понижается по мере увеличения концентрации диоксана. Прямые линии означают предельные наклоны кривых по Дебаю - Хюккелю. В общем, можно считать, что при данной концентрации растворенного вещества отклонение его коэффициента активности от единицы увеличивается с уменьшением диэлектрической проницаемости растворителя. [11]
Настоящая статья посвящена количественным закономерностям экстракции. Чтобы исследовать эти закономерности систематически, дается классификация экстракционных равновесий, а затем рассматриваются общие закономерности экстракции и равновесия всех перечисленных в классификации типов. При этом обсуждается возможность предсказания констант равновесия, производятся теоретические расчеты коэффициентов активности и констант комп-лексообразования, развивается теория высаливания и теория экстракции смешанными растворителями и экстрагентами с разбавителями, выводятся соотношения, определяющие растворимость третьего вещества ( воды) в бинарной системе ( ТБФ с разбавителями), разбирается вопрос о форме изотерм экстракции и методике их количественного расчета. [12]
Страницы: 1