Термодинамический расчет - константа - равновесие
Cтраница 1
Термодинамический расчет констант равновесия и запись уравнений закона действующих масс не вызывают затруднений. Уже подчеркивалось, что удобно для газовых реакций использовать константы KN, а для реакций в растворах / Сс, так как в этом случае упрощается переход к конверсиям или химическим переменным. [1]
Для термодинамических расчетов констант равновесия требуется, как известно, знание энтропии и теплот образования реагентов при различных температурах. [2]
При термодинамических расчетах констант равновесия необходимо знать зависимость стандартного изменения изобарного потенциала от температуры. [3]
В основе термодинамического расчета констант равновесия химических реакций лежит соотношение между стандартными изобарно. [4]
 |
Константы равновесия К р для взаимных переходов. [5] |
При анализе возможных результатов процесса Клауса используют термодинамические расчеты констант равновесия и равновесных составов, поскольку при температурах процесса экспериментальные выходы продуктов близки к равновесным. [6]
Это очень важные уравнения, которые положены в настоящее время в основу термодинамических расчетов констант равновесия. [7]
Непрерывное проведение химического процесса осуществляется при прохождении потока вещества через реактор. При установившемся процессе количество прореагировавших веществ на участке между началом и концом реактора представляет собой величину постоянную. Количество молей вещества, проходящих в единицу времени через любое сечение реактора, не зависит от продолжительности работы установки. Кинетическому исследованию должен предшествовать термодинамический расчет константы равновесия реакции при данных условиях. Этот расчет необходим для правильного определения степеней превращения. Кинетическое исследование реакции в потоке должно установить связь между выходом продукта реакции, степенью превращения исходных веществ и объемной скоростью подачи исходных веществ в реактор, в котором осуществляется реакция. [8]
Так, в 1935 г. Винн-Джонс и Эйринг показали, что образующийся при реакциях замещения анилинов с различными бензоилхлоридами активный комплекс будет сильно полярен и будет обладать в соответствии с этим высокой энтропией активации [ 349, стр. Поскольку в рассмотренных реакциях строение активного комплекса фактически одинаково, энтропия активации остается почти постоянной, а изменение скоростей реакций оказывается обусловленным лишь различными энергиями активации. В общем теория абсолютных скоростей реакций сводит проблемы кинетики к термодинамическому расчету константы равновесия для активированного комплекса ( и исходных молекул. [9]
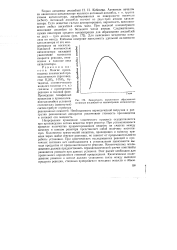 |
Зависимость вероятности образования активных ансамблей от концентрации катализатора. [10] |
Непрерывное проведение химического процесса осуществляется при прохождении потока вещества через реактор. При установившемся процессе количество прореагировавших веществ на участке между началом и концом реактора представляет собой величину постоянную. Количество грамм-молей вещества, проходящих в единицу времени через любое сечение реактора, не зависит от продолжительности работы установки. Кинетическому исследованию должен предшествовать термодинамический расчет константы равновесия реакции при данных условиях. Этот расчет необходим для правильного определения степеней превращения. [11]
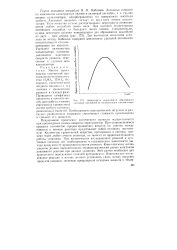 |
Зависимость иерояпюсти образования активных ансамблей от концентрации катализатора. [12] |
Непрерывное проведение химического процесса осуществляется при прохождении потока вещества через реактор. При установившемся процессе количество прореагировавших веществ па участке между началом и концом реактора представляет собой величину постоянную. Количество грамм-молей вещества, проходящих в единицу времени через любое сечение реактора, не зависит от продолжительности работы установки. Кинетическому исследованию должен предшествовать термодинамический расчет константы равновесия реакции при данных условиях. Этот расчет необходим для правильного определения степеней превращения. [13]
Страницы: 1