Расщепление - кольцо
Cтраница 1
Расщепление кольца в результате нуклеофильной атаки, обычно при действии щелочей, описано в разд. [1]
Расщепление кольца в результате нуклеофилыюй атаки, обычно при действии щелочей, описано в разд. [2]
Расщепление кольца в молекуле хлоркатехола осуществляется окислением хлоркатехола в хлор-цмс цмс-муконовую кислоту с участием пирокатехазы II. Этот фермент действует специфически в большей степени на хлоркатехол, чем на его незамещенный предшественник. Дегалогенирование, по-видимому, является спонтанной реакцией, протекающей одновременно с действием второго модифицированного фермента циклоизоме-разы II, одинаково активного как для галогензамещенных молекул, так и для их предшественников. [3]
Расщепление кольца, подобное расщеплению по реакции Цинке, в некоторых случаях для получения альдегидов проводилось н с другими азотсодержащими гетероциклическими соединениями. [4]
Расщепление кольца с образованием алкенов и диенов. [5]
Расщепление кольца в пятичленных гетероароматических системах ( фуран, тиофен и пиррол) проявляется очень слабо. [6]
Расщепление серного кольца может, по данным Кребса [145], как правило, происходить двумя путями, как это легко можно себе представить при рассмотрении электронной структуры 88-цикла. С одной стороны, при раскрытии цикла электронная пара может остаться у одного атома серы; в таком случае на другом конце образовавшейся 88-цепи создается недостаток электронов, с другой стороны, - каждый из концевых атомов серы может присоединить один электрон. [7]
Расщепление циклопропено-вого кольца с образованием соединений II и IID ( направление б) происходит, по-видимому, синхронно ( Па): одновременно с расщеплением одинарной связи С2 - С3 и образованием двойной связи между атомами Ci и С3 осуществляется присоединение фрагментов бор-аллил к атому углерода Са. Получающееся аллильное производное бора ( Пб) претерпевает быструю [20, 21] внутримолекулярную аллильную перегруппировку в соединение II, в котором атом бора связан с концевым углеродным атомом аллильной системы. [8]
Расщепление лактошюго кольца осуществляется у разных лакто-пов с различной легкостью; при кипячении с водой происходит их обратное превращение в оксикислоты, причем устанавливается состояние равновесия. [9]
Расщепление изоксазольиого кольца часто наблюдается в условиях восстановления; например, при действии натрия в спирте образуются р-иминокетоны ( схема 100) [95]; восстановление амальгамой или никелем Ренея также дает продукты разрыва связи N-О. Такие реакции включают восстановительное расщепление с присоединением на его первой стадии одного или двух электронов. [10]
Расщепление колец циклических эфиров, лактонов и фталидов цианистым водородом приводит к образованию нитрилов. [11]
Если расщепление кольца прошло бы главным образом в другом папранлс-нии, то конечным продуктом реакции была бы а-пи-ко липовая кислота. [12]
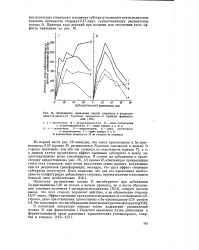 |
Зависимость окисления смесей стероидов в андроста-диен-1 4-дион - 3 17 Fusarium caucasicum от времени ферментации. [13] |
Поскольку расщепление кольца D ингибируется при добавлении 5а - прегнандиона-3 20 не только в начале процесса, но и после образования заметных количеств 1-дегидротестололактона ( XLI), следует сделать вывод, что этот стероид подавляет действие, а не образование стероид-13 17-лиазы. [14]
Легкость расщепления кольца зависит от характера и положения заместителя, а также от основности амина. Электронодонорные заместители стабилизируют С-N - связи кольца, а - заместители делают ядро совершенно устойчивым. С увеличением основности амина легкость расщепления возрастает. В реакции могут быть использованы гетероциклические ( например, 6-аминохинолин) и алифатические амины. [15]
Страницы: 1 2 3 4