Расщепление - метан
Cтраница 1
Расщепление метана может происходить в свободном объеме-гомогенно или на насадке ( катализаторе) - гетерогенно. Гомогенное разложение метана характеризуется образованием тонкодисперсного углерода, уносимого газовым потоком из зоны реакции. При гетерогенном распаде метана на поверхности контакта отлагается плотный слой углерода: Экспериментально показано [101], что температура гетерогенного разложения метана может быть на 150 - 200 С ниже, чем гомогенного разложения. [1]
Процесс термического разложения этана и более сложных парафинов несомненно родственен по своей природе процессу расщепления метана. Раис и Дулей ( 1934 г.) указывают, что при пропускании чистого этана через кварцевую трубку, которая нагревается в печке до 850 - 950, получаются активные частицы, являющиеся, возможно, свободными метальными радикалами. Энергия активации процесса образования радикалов была найдена равной приблизительно 80000 кал. Этилен и водород получаются при этом в больших количествах. [2]
Из числа приводимых ниже методов получения водорода большое техническое значение имеют: получение водорода ( или азото-водородной смеси) из водяного газа путем конверсии СО ( контактный способ получения водяного газа), из природного газа или коксового газа в результате расщепления метана, из коксового газа или водяного газа фракционным сжижением, далее - электролизом воды и железо-паровым способом. В качестве важнейшего побочного продукта водород получается в процессе электролиза водных растворов хлоридов щелочных металлов и при дуговом способе получения ацетилена. [3]
Из числа приводимых ниже методов получения водорода большое техническое значение имеют: получение водорода ( или азото-водородной смеси) из водяного газа путем конверсии СО ( контактный способ получения водяного газа), из природного газа или коксового газа, в результате расщепления метана, из коксового газа или водяного газа фракционным сжижением, далее - электролизом воды и железо-паровым способом. В качестве важнейшего побочного продукта водород получается в процессе электролиза водных растворов хлоридов щелочных металлов и при дуговом способе получения ацетилена. [4]
При крекинге метана, в зависимости от условий его проведения, наряду с углеродом ( сажа) и водородом образуются в различных соотношениях также ацетилен, этилен, бутадиен и бензол. Предполагают, что промежуточной стадией процесса является расщепление метана с образованием радикала метилена и водорода. [5]
Кассель ( 1935 г.) рассматривал две возможности первичного разложения метана с точки зрения кинетики реакции и пришел к выводу, что его опыты в кварцевых сосудах при 800 не совместимы с образованием метильных радикалов, но могут быть объяснены с помощью механизма, в котором участвует метилен. Все имеющиеся факты отвечают, повидимому, той точке зрения, что в результате расщепления метана при высоких температурах получается метилен. Учитывая его реакционную способность, станет понятно, почему Раис и Дулей не обнаружили его при взятых ими условиях опыта. Свободные радикалы метилена должны при температурах выше 1000 иметь исключительно малую продолжительность жизни. Поэтому их обнаружение возможно только на очень небольшом расстоянии от места их образования. [6]
Процесс конверсии протекает при нагревании метана до 1000 - 1100 С, а в присутствии катализатора и при более низкой температуре. При этом получается расщепление метана на водород и углерод. Из смеси окиси углерода с водородом можно получить метиловый и этиловый спирты и другие продукты, в том числе газ для сварки, растворители, синтетический каучук, лаки. [7]
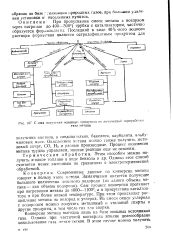 |
С. ема получения основных продуктов от химической перерабсмкн. [8] |
Сам процесс конверсии протекает при нагревании метана до 1000 - 1100, а в присутствии катализатора и при более низкой температуре. При этом происходит расщепление метана на водород и углерод. Из смеси окиси углерода с водородом можно получить метиловый и этиловый спирты и другие продукты, в том числе газ для сварки. [9]
Термическое разложение углеводородов связано с промежуточным образованием термически устойчивого углеводорода - метана. Данные о равновесии этой реакции приводились в гл. Теоретически разложение метана на 98 - 99 % должно происходить при 1000 - - 1200 С. Однако при таких температурах скорость расщепления метана до элементов еще недостаточна, и для достижения приемлемых выходов водорода процесс приходится вести в интервале 1350 - 1400 С. Скорость термического разложения метана может быть увеличена при использовании катализаторов, содержащих железо, никель и другие металлы. [10]
Процесс горения метана делится на две стадии: 1) быстрое горение во фронте пламени, при котором практически расходуется весь кислород; 2) относительно медленное изменение состава газовой смеси ( Н2О, СО2, СО, Н2, С2Н3 и СН4), протекающее в отсутствии свободного кислорода. Основное количество ацетилена образуется в первой стадии, но образование его продолжается и во второй. Отличительной особенностью процесса термоокислительного пиролиза метана является то, что он сопровождается горением и является огневым процессом. При этом тепло, необходимое для реакции расщепления метана, получается при сжигании части углеводородных газов, поступающих в зону реакции. [11]
 |
Состав газа и степень превращения метана в водород в условиях достижения термодинамического равновесия. [12] |
Для некоторых газообразных углеводородов константы равновесия приведены в табл. 42 ( см. Приложение, стр. Углеводороды с числом углеродных атомов 1 легче подвергаются расщеплению. Кроме того, при расщеплении углеводородов также образуется метан. Таким образом, концентрация Н2 в продуктах реакции определяется термодинамическим равновесием расщепления метана. Данные по константам термодинамического равновесия реакций расщепления других углеводородов показывают, что уже при сравнительно низких температурах имеются термодинамические условия для расщепления углеводородов с выпадением углерода. [13]
Было установлено, что метан и водяной пар при температуре - 500 над металлическим никелем или кобальтом превращаются в углекислоту и водород. В 1928 г. Фишер и Тропш [4] провели исследование влияния различных катализаторов на расщепление метана паром. Келлер и Клемпт [5] установили, что окиси щелочноземельных металлов, прежде всего доломит и магнезит, оказывают значительное каталитическое действие на превращение углерода с водяным паром. За последние два десятилетия разработаны многочисленные методы превращения газообразных и жидких углеводородов с водяным паром. [14]
Страницы: 1