Расщепление - силоксановая связь
Cтраница 2
Низкая величина энергии активации процесса деструкции ( 20 - - 70 ккал / моль) по сравнению с энергией связи Si-О ( 101 - - 118 ккал / моль, см. табл. 2), по-видимому, обусловливается облегчением расщепления силоксановой связи в результате образования переходного комплекса. [16]
Из-за низкой равновесной концентрации высокомолекулярные полисилоксаны, в особенности с полярными заместителями у атомов кремния, могут быть получены с высоким выходом полимеризацией только тех циклосилоксанов, равновесная концентрация которых мала, причем полимеризация должна проводиться в условиях, исключающих расщепление силоксановой связи в полимере. Практически для получения высокомолекулярных полисилоксанов, например метил ( ЗДЗ-трифторпропил) силоксанового [1343] или метилфенилсилоксанового [1468], в качестве исходных мономеров используются соответствующие циклотрисилоксаны. [17]
Распад D4 протекает в несколько стадий. Первая стадия - расщепление силоксановой связи с образованием линейного сило-ксана является медленной, вторая - дальнейшее превращение линейного силоксана в полимер происходит быстро. Было высказано предположение, что протонирование силоксанов, подобно силанам [117], описывается функцией кислотности Но. [18]
Поэтому силоксановый кислород в переходном состоянии является донором электронной пары, чем обусловлена его высокая активность в реакциях через переходный комплекс. Следовательно, всякое расщепление силоксановой связи в реакциях протекает через взаимодействие реагентов с обоими центрами силоксановой связи. [19]
При введении в эту систему олефинов происходит их полимеризация. Идет ли здесь расщепление силоксановых связей с вступлением титана в структуру полимера или имеет место комплексообразование - сказать пока трудно. [20]
Имеющихся экспериментальных данных еще недостаточно для уверенного выбора между предложенными механизмами. Наиболее вероятно протекание реакций расщепления силоксановых связей с участием ионных пар по схемам (1.5) и ( 1 - 6) и близким к ним или по четырехцентровым схемам типа (1.8), но с разделенными зарядами. [21]
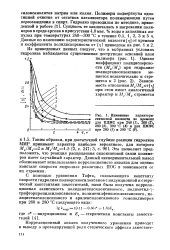 |
Изменение характеристической вязкости во времени для ПДМС при 240 ( 7, 260 ( 2, 280 ( 3, 300 С ( 4 и для ПМФС при 280 ( 5 и 300 С ( 6. [22] |
Таким образом, при достаточной глубине реакции гидролиза ММР принимает характер наиболее вероятного, для которого MJM2 и М / М 1.5 [ 2, с. Это позволяет предположить, что реакция расщепления силоксановой связи полимеров имеет случайный характер. Данный экспериментальный вывод обосновывает использование корреляционного анализа для оценки констант скорости гидролиза различных ПОС в зависимости от их строения. [23]
В настоящее время наиболее подробно изучена реакция линейных и циклических силоксанов с хлорсиланами. Однако в большинстве патентов [1114 - 1125] ив некоторых публикациях [1126- 1130] i указывается на возможность расщепления силоксановой связи галогенсиланами или галогенсилоксанами. [24]
Поскольку реакции расщепления дисилоксанов соединениями фосфора будут подробно рассмотрены в разделе 1.1.5, здесь можно лишь указать, что при взаимодействии сылш-дивинилтетраэтоксидисило-ксана с Р205 эфир не выделяется. Не вызывает сомнения, что в данном случае внедрение фосфора в структуру происходит путем расщепления силоксановой связи. Однако возможность одновременного этоксилирования фосфора при этом процессе еще более сомнительна и описание структуры полимера формулой (1.41) являлось бы вполне логичным. [25]
Полидиэтилсилоксаны, полученные при реакциях монокарбоновых кислот с диэтилдиэтоксисиланом, практически полностью перегоняются до 200 С при 1 мм рт. ст. Фракционный состав их не зависит от природы кислоты, ее количества и концентрации в отличие от состава полидиэтилсило-ксанов, образующихся при реакциях минеральных кислот с диэтилдиэтоксисиланом. Это указывает на то, что монокарбоновые кислоты в условиях реакций ( температура не выше 125 С) не вызывают расщепления силоксановой связи в образовавшихся полимерах, приводящего в случае минеральных кислот к укрупнению циклов. [26]
Ангидриды органических кислот медленнее реагируют с силок-санами, чем ангидриды минеральных кислот. При кипячении D [1034] - или гексаалкилдисилоксанов ( R3Si) 2O, где RCH3, C2H5 или C6Hs [1035], с уксусным или бензойным ангидридом расщепления силоксановых связей не наблюдается. [27]
В предлагаемой вниманию читателя книге авторы попытались тщательно и критически обобщить все накопившиеся в мировой литературе данные, тем или иным образом касающиеся основных аспектов проблемы силоксановой связи. В монографии по возможности исчерпывающе рассмотрены природа, физические и химические свойства связи Si-О и ее способность к комплексо-образованию. Реакции расщепления связи Si-О в неорганических соединениях кремния рассмотрены менее подробно, что обусловлено как ограниченным объемом книги, так и профессиональными интересами самих авторов - специалистов в области кремнийор-ганической химии. В монографии не освещаются многочисленные реакции расщепления силоксановой связи в группировках Si-О - М ( М - металл, металлоид), так как библиография по этому вопросу настолько обширна, что его обсуждение могло бы стать предметом отдельной книги. [28]
Страницы: 1 2