Раулем
Cтраница 1
Раулем, применяется для определения молекулярного веса растворенного в-ва, а также его активности в растворе, что дает возможность в соответствующих случаях рассчитывать осмотич. [1]
Раулем ( 1884 г.) на основании многочисленных измерений было показано, что давление насыщенных паров р растворителя над раствором нелетучего вещества меньше, чем давление насыщенных паров р0 над чистым растворителем при той же температуре. [2]
Аналогичные законы установлены Раулем и в отношении повышения температуры кипения растворов. [3]
Это соотношение, установленное Раулем эмпирическим путем, показывает, что при постоянной температуре относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества. [4]
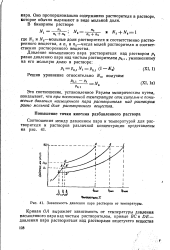 |
Зависимость давления пара растворов от температуры. [5] |
Это соотношение, установленное Раулем эмпирическим путем, показывает, что при постоянной температуре относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества. [6]
Законы, установленные Вант-Гоффом и Раулем, позволили ввести в лабораторную практику два новых метода определения молекулярного веса тел: криоскопический, основанный на определении точки замерзания, и эбулиоскопический, основанный на определении точки кипения. [7]
Уравнение (11.8) впервые было получено эмпирически Раулем и называется законом Рауля. [8]
Процессы замерзания и кипения растворов были детально изучены Раулем ( 1882), который установил закон, впоследствии названный его именем. [9]
Процессы замерзания и кипения растворов - были детально изучены Раулем ( 1882), который установил закон, впоследствии названный его именем. [10]
Важную роль в обобщении новых фактов сыграли открытые Вант-Гоффом ( 1887 г.) и Раулем ( 1882 - 1885 гг.) законы, которые дали химикам возможность получить в определенной степени объективную информацию о молекулярной массе смолообразных, клееобразных и каучукообразных продуктов синтеза, а также таких природных полимеров, как каучук, целлюлоза и крахмал, путем экспериментального определения молекулярных масс криоскопическим, эбулиоскопическим и осмометри-ческим методами. Интересно отметить, что Настюков впервые обратил внимание исследователей на необходимость проведения измерений осмотического давления и изменения температур кипения и замерзания при различных концентрациях с целью экстраполяции данных на нулевую концентрацию. [11]
Теория электролитической диссоциации, созданная Аррениу-сом в 80 - х годах прошлого века, находится в полном согласии с экспериментальными данными, полученными Раулем, а до него Рюдорффом и де Коппе. В водных растворах молекула таких солей, как NH4C1, NaCl, KC1, NH4NO3, NaNO3 распадается на два иона. [12]
Теория электролитической диссоциации, созданная Арре-ниусом в 80 - х годах прошлого века, находится в полном согласии с экспериментальными данными, полученными Раулем, а до него Рюдорффом и де Коппе. [13]
Математическая интерпретация идеального раствора предложена Дж. Раулем и связана с линейными изменениями давления насыщенных паров раствора в зависимости от мольных концентраций, входящих в раствор чистых компонентов. [14]
Итак, понижение температуры замерзания разбавленного раствора, как и повышение температуры кипения его, пропорционально концентрации растворенного вещества. Это утверждение также впервые было высказано Раулем и называется вторым законом Рауля. [15]
Страницы: 1 2