Раулинсон
Cтраница 1
Раулинсон изучил также молибденовый цианид калия зМо ( СМ) 8, в котором молибден пятивалентен. Эффективный мо-ент этого соединения равен 1 66 магнетона Бора. [1]
Позднее Раулинсон и Ричардсон ( Rowlinson, Richardson, 1959) использовали уравнение ( 18) для проверки правильности выражений, предложенных для подсчета сил межмолекулярного взаимодействия. [2]
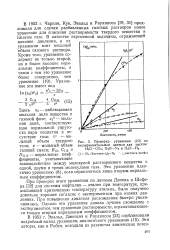 |
Проверка уравнения ( 10 по. [3] |
В 1952 г. Чарнли, Кук, Эвальд и Раулинсон [19, 31] предложили для случая разбавленных газовых растворов новое уравнение для описания растворимости твердого вещества в сжатом газе. [4]
В 1952 г. Чарнли, Кук, Эвальд и Раулинсон ( Charnley, Cook, Ewald, Rowlinson) предложили для разбавленных газовых растворов новое уравнение, описывающее растворимость твердого вещества в сжатом газе. [5]
В качестве силовых постоянных для паров воды применяем вычисленные Раулинсоном постоянные с учетом диполь-квадру-польного взаимодействия по модифицированному потенциалу Штокмайера. Наибольшее расхождение между экспериментальными значениями В 2 ( Т) и вычисленными по потенциалу Штокмайера получается при температуре выше 100 С; при температуре 100 С совпадение хорошее; в связи с этим можно ожидать, что при Т 293 К эти силовые постоянные дают достаточно точный результат. [6]
Соотношение между различными производными протопорфи-на железа может быть уяснено при помощи табл. 29, заимство-нной из статьи Раулинсона. [7]
Для химического потенциала при этом были использованы те же уравнения, выведенные при помощи статистической термодинамики, которые были использованы Робе-ном и Чарнли, Куком, Эвальдом и Раулинсоном. Давление выражено авторами через объем при помощи уравнения состояния с вириальными коэффициентами. [8]
Известен еще ряд обзорных работ, посвященных вопросу растворимости твердых и жидких веществ в сжатых газах: Бусс и Бидуэлла ( Booth, Bidwel, 1949), Робена ( Robin, 1953), Жузе ( 1958), Раулинсона и Ричардсона ( Rowlinson, Richardson, 1959) и др. В ранних обзорах Ингерсона ( Ingerson, 1934) и Гиллингхэма ( Gillingham, 1948) рассмотрено растворение в сжатых газах, и в том числе в водяном паре, веществ, представляющих интерес для геологов. [9]
В качестве силовых постоянных для паров воды применяем вычисленные Раулинсоном постоянные с учетом диполь-квадру-польного взаимодействия по модифицированному потенциалу Штокмайера. Наибольшее расхождение между экспериментальными значениями Вы ( Т) и вычисленными по потенциалу Штокмайера получается при температуре выше 100 С; при 100 С совпадение хорошее; в связи с этим можно ожидать, что при Т 293 К выбранные силовые постоянные дают достаточно точный результат. [10]
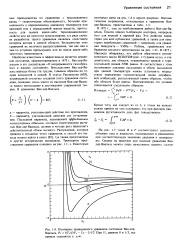 |
Изотермы приведенного уравнения состояния Ван-дер - Ваальса, Рг 8Tr / ( 3Vr - 1 - 3 / Уг - При Vr, равном 0 и 1 / 3, все кривые стремятся к оо. [11] |
Наиболее известным и эффективным является уравнение состояния, сформулированное в 1873 г. Ван-дер - Ва-альсом в его диссертации О непрерывности газообразных и жидких состояний. Впоследствии Ван-дер - Ва-альс написал более ста трудов, главным образом по теории жидкостей и смесей. В статье Раулинсона [603], посвященной столетию создания этого уравнения состояния, показано, сколь много из наследия Ван-дер - Вааль-са нашло воплощение в достижениях современной теории. [12]
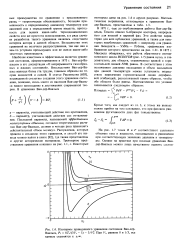 |
Изотермы приведенного уравнения состояния Ван-дер - Ваальса, Рг 8Tr / ( 3Vr - 1 - 3 / Уг - При Vr, равном 0 и 1 / 3, все кривые стремятся к оо. [13] |
Наиболее известным и эффективным является уравнение состояния, сформулированное в 1873 г. Ван-дер - Ва-альсом в его диссертации О непрерывности газообразных и жидких состояний. Впоследствии Ван-дер - Ва-альс написал более ста трудов, главным образом по теории жидкостей и смесей. В статье Раулинсона [603], посвященной столетию создания этого уравнения состояния, показано, сколь много из наследия Ван-дер - Вааль-са нашло воплощение в достижениях современной теории. [14]
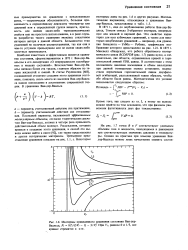 |
Изотермы приведенного уравнения состояния Ван-дер - Ваальса, Рг 8ГГ / ( ЗК, - 1 - З / Vj. При Vr, равном 0 и 1 / 3, все кривые стремятся к о. [15] |
Страницы: 1 2