Реакция - кальций
Cтраница 1
Реакция кальция с горячей водой идет энергично. [1]
Метод основан на реакции кальция с пурпуратом аммония ( мурексидом) 1 в слабощелочном растворе, при которой образуется соединение, окрашенное в красный цвет. В отсутствие кальция раствор окрашен в фиолетовый цвет. Другие примеси, присутствующие в чистых препаратах германия, не мешают определению. [2]
Прокаленный остаток после растворения его в соляной кислоте дает реакции кальция. [3]
Для определения жесткости воды по кальцию предназначен метод, основанный на реакции кальция с трилоном Б при рН 12 - 13 в присутствии мурексида в качестве индикатора. В этих условиях магний выпадает в осадок в виде гидроокиси магния, а мурексид реагирует только на ионы кальция. [4]
Для качественного обнаружения кальция используются некоторые флуоресцентные реакции. Реакция кальция с оксихинолином находит широкое применение в хроматографии на бумаге. [5]
 |
Схема распада Na24, Дить. осаждая гидрат окиси магния или. [6] |
При реакции кальция с дейтронами и скандия с нейтронами образуются радиоактивные кальций, калий и скандий. [7]
В той же последовательности происходит повышение химической активности. Так, бериллий с водой не взаимодействует, магний реагирует слабо, реакция кальция с водой протекает весьма бурно. Следовательно, активность стронция и бария по отношению к воде соответственно повышается. [8]
С увеличением температуры уменьшается пластическая вязкость промывочных жидкостей и возрастает фильтратоот-дача; статическое и динамическое напряжение сдвига глинистых суспензий, как правило, возрастают. Глинистые суспензии, обработанные кальцием, при температуре свыше 130 С могут затвердевать в результате образования гидроалюмосиликатов кальция при реакциях кальция с глиной и кремнеземом. [9]
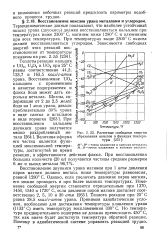 |
Расчетные свободные энергии образования окислов в функции температуры. [10] |
Термодинамические данные показывают, что наиболее устойчивый окисел урана ( двуокись) должен восстанавливаться кальцием при температурах ниже 2300 С, магнием ниже 1280 С и алюминием при всех температурах. При температурах выше 2300 С окисел должен восстанавливаться углеродом. Теплоты реакции кальция с UO2, U3O8 и UO3 при 25 С равны соответственно 44 2; 123 7 и 163 5 ккал / г-атом урана. Восстановление UO3 кальцием с применением в качестве подогревателя и флюса йода может дать корольки металла. [11]
В любой титриметрической системе общее изменение тепла в процессе титрования может происходить в результате протекания различных реакций, при этом не все они способствуют получению хорошей конечной точки титрования. В тех случаях, когда в системе протекает несколько поледовательных реакций с разными тепловыми эффектами, выделение различного количества тепла может повлечь за собой изменение наклона энталь-пограммы и таким образом существенно повлиять на четкость конечной точки титрования. Иногда, например, при титровании раствора кальциевой соли раствором EDTA в присутствии небольших количеств солей магния такое явление может быть выгодно использовано. Последовательность реакций такова, что кальций титруется первым и только после того, как весь кальций будет связан в комплексное соединение с EDTA начнется реакция с магнием. Реакция кальция с EDTA экзотермическая, а реакция магния эндотермическая. Смена экзотермической реакции на эндотермическую используется для заострения конечной точки титрования при определении кальция. [12]
Реактор непрерывного действия представляет собой вертикальную полочную электропечь, в которой измельченный кальций пересыпается с полки на полку. В среднюю часть печи для регулирования скорости реакции подают аргон. Если получение гидрида кальция ведут при темпе-ратуре - 600 С и регулируют процесс подачей водорода так, что-бы избежать подъема температуры и расплавления кальция, то в реторте создается значительный вакуум. В этих условиях возможен подсос воздуха через различные неплотности, что приводит к загрязнению получаемого продукта нитридом кальция. Снижение температуры на начальной стадии процесса до 400 С при интенсивном поглощении водорода, а при завершении реакции до 500 С позволяет повысить выход до 96 %, так как в этих условиях реакция кальция с азотом идет очень медленно. Продолжительность гидрирования ( 17 - 19 ч) при этом не изменяется, а расход электроэнергии значительно сокращается. [13]
Страницы: 1