Реакция - кобальт
Cтраница 1
Реакции кобальта с ними очень чувствительны, но неселективны, мешают обычные спутники - нлкель, медь, железо. [1]
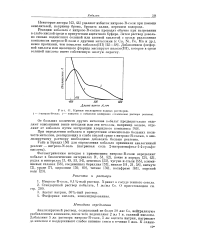 |
Кривые поглощения водных растворов. 1 - 1-нитрозо - Н - соль. 2 - комплекс с кобальтом ( измерения относительно раствора реагента. [2] |
Реакцию кобальта с нитрозо - К-солью проводят обычно при нагревании в слабо кислой среде в присутствии ацетатного буфера. Добавлением фосфорной кислоты или щелочного фторида маскируют железо ( Ш), которое в среде соляной кислоты имеет собственную желтую окраску. [3]
Сендел ( 1964), реакция кобальта и никеля с дитизоном необратима. Кобальт, как и никель, в кислой среде почти не реагирует с дитизоном, но их дитизонаты, образовавшиеся в щелочной среде, не разлагаются при действии на них разбавленной кислоты. [4]
В настоящее время найдено, что реакции кобальта ( 111) катализируют некоторые твердые добавки, например древесный уголь. Водный раствор [ Со ( ЫНз) в ] С1 3 при кипячении в течение нескольких часов не изменяет своего желто-оранжевого цвета, что указывает на отсутствие реакции. [5]
Его получают в эфире [ 21 или в бензоле [ 31 при реакции кобальта Ренея с окисью углерода при 150 под давлением 224 апш. [6]
Ион никеля дает такую же реакцию, но получаемая при этом окраска выражена значительно слабее. Тем не менее открытие этой реакцией кобальта в присутствии никеля ненадежно. [7]
По данным В. М. Звенигородской для устранения влияния железа необходимо на 1 вес. Такой избыток последнего практически не влияет на реакцию кобальта с роданидом. Никель в этих условиях образует нерастворимую соль Ni2P2O7 бледнозеленого цвета. Для связывания никеля в виде пирофосфата необходимо создать рН среды яо возможности не ниже семи. Однако с повышением величины рН кобальт осаждается в виде пирофосфата. [8]
Согласно исследованиям В. М. Звенигородской, наиболее благоприятные условия создаются при введении около 8 - 9 вес. В этом случае железо полностью связывается пирофосфатом, и в то же время реакция кобальта с роданидом протекает нормально. [9]
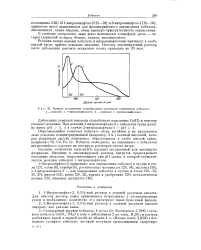 |
Кривые поглощения хлороформных растворов комплексов кобальта. 1 - комплекс с 1-нитрозонафтолом - 2. 2 - комплекс с 2-нитрозонафтолом - 1. [10] |
Большие количества железа ( Ш) удаляют экстракцией или маскируют фторидами. Введение в анализируемый раствор цитратов предотвращает осаждение металлов, гидролизующихся при рН среды, в которой осуществляется реакция кобальта с нитрозонафтолом. [11]
Сообщается [240], что скорость растворения металлического кобальта в перекиси водорода с образованием иона двухвалентного кобальта соответствует реакции первого порядка по разности между мгновенной концентрацией кобальта в растворе и концентрацией его в состоянии насыщения и зависит от рН раствора и концентрации перекиси водорода. При более высоких рН образуется гидрат окиси трехвалентного кобальта. Наряду с этим исследование реакции кобальта с перекисью водорода [241] показало также, что растворенный ион трехвалентного кобальта количественно восстанавливается перекисью водорода. Скорость реакции соответствует первому порядку по концентрации как иона трехвалентного кобальта так и перекиси водорода и обратно пропорциональна концентрации водородных ионов. Для объяснения этого предложены две стадии с переносом одного электрона и с участием радикала пергидроксила; в реакции, возможно, как уже предложено выше для реакции с ионом четырехвалентного церия, участвуют димерпые гидратировапные ионы трехвалентного кобальта. Химия родия и иридия в реакциях с перекисью водорода не исследована. [12]
Метод позволяет проводить определение кобальта в почвах без предварительного отделения кобальта от железа и других мешающих элементов. Существует большое количество различных вариантов определения кобальта с 2-нитрозо - 1-нафтолом. Прибавляют для окисления железа и ускорения реакции кобальта с 2-нитрозо - 1-нафтолом 1 мл 30 % - ной Н2О2 и оставляют на 5 мин. Прибавляют для связывания железа, алюминия, кальция и магния 10 мл 20 % - ного раствора лимоннокислого аммония, 1 мл 10 % - ного раствора гипосульфита и 1 каплю фенолфталеина. Прибавляют по каплям концентрированный раствор аммиака до появления слабо-розовой окраски. Затем приливают 2 мл 0 04 % - ного раствора 2-нитрозо - 1-нафтола, перемешивают и оставляют на 20 - 30 мин для полного образования комплекса кобальта с 2-нитрозо - 1-нафтолом. [13]
Страницы: 1