Реакция - бромистый метил
Cтраница 1
Реакции бромистого метила с любым из взятых ионов всегда идут быстрее, чем реакции других метилгалогенидов с этим же ионом, причем параметр А2 во всех случаях больше, чем для других членов ряда. [1]
Реакции бромистого метила с любым из взятых ионов всегда идут быстрее, чем реакции других метилгалогенидов с этим же ионом, причем параметр А 2 во всех случаях больше, чем для других членов ряда. [2]
В результате реакции выделившегося бромистого метила с кокаином образуется некоторое количество бром мети л а та кокаина. [3]
Наблюдается также увеличение выхода водородсодержащих соединений кремния в сравнении с реакцией бромистого метила с кремнием. При 320 - 380 в продуктах реакции содержалось - 3 / 6 трибром-силана и - 3 - 4 % этилдибромсилана. [4]
Примите в дальнейшем, что растворы идеальны, и пренебрегите скоростями реакций бромистого метила с водой или уксусной кислотой и какими-либо последующими реакциями метилацетата. [5]
На основании этого он сделал вывод, что заключение Свэна о тримолекулярном характере реакции бромистого метила с пиридином в бензоле - ошибочно. [6]
Свэн, изучая реакцию бромистого метила с пиридином в бензоле ( как пример SN 2-реакщш), пришел к выводу, что и она протекает по тримолекулярному механизму. [7]
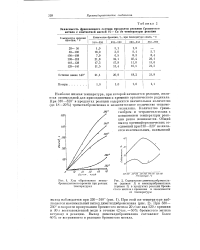 |
Ход образования метил.| Содержание диметилдибромсила-па ( кривая 1 и метилтрибромсилапа ( кривая 2 в продуктах реакции бромистого метила с кремнием в зависимости от температуры. [8] |
Выход диметилдибромсилана составляет более 40 % от вступившего в реакцию бромистого метила. [9]
Имеется водный раствор, 0 01 М по бромистому метилу и 1 0 М по ацетату натрия при 50 С. Примите в дальнейшем, что растворы идеальны, и пренебрегите скоростями реакций бромистого метила с водой или уксусной кислотой и какими-либо последующими реакциями метилацетата. [10]
Поскольку реакции алкил ( арил) галоидпроизводных с кремнием протекают при высоких температурах, успех их в первую очередь зависит от термической устойчивости галоидпроизводного. Независимо от природы галоидпроизводного, температура реакции имеет влияние на выход и состав соединений кремния. Установлено, что пиролиз бромистого метила и бромбензола при температурах образования метил - и фенилбромсиланов протекает в незначительных количествах. Однако реакция бромистого метила с кремнием ниже 320 проходит со значительным образованием три-метилбромсилана, тогда как выше 360 количество его резко снижается, а количество метилтрибромсилана возрастает. Аналогично меняется в зависимости от температуры и состав продуктов реакции бромбензола с кремнием. [11]
 |
Константы скорости [ в л / ( моль с ]. [12] |
Таким образом, эта кинетическая схема [15] удовлетворительно объясняет основные кинетические особенности реакции независимо от того, рассматривается ли этот процесс в прямом или обратном направлении. Она объясняет также, почему константа к в работах Ингольда уменьшается по мере протекания реакции и принимает различные значения для растворов переменной концентрации. Правильность предложенного нами механизма была установлена в работе [54], в которой определяли скорости реакции н-бутил-га-бром - бензолсульфоната с хлористым, бромистым и йодистым литием, а также хлористым, бромистым и йодистым тетра-н-бутиламмонием. Во втором столбце таблицы приведены стехиометрические константы второго порядка, рассчитанные по методу Ингольда. В третьем столбце даны бимолекулярные константы скорости реакции между органическим бромидом и ионами G1 -, Вг - и I - по механизму, описанному выше. Как отметил Уинстейн [54], поучительно сопоставить эту последовательность с относительными скоростями реакций бромистого метила с ионами галогенов в том же растворителе и при той же температуре в рамках интерпретации кинетики и механизма процесса по Ингольду. [13]
 |
Константы скорости [ в лДмоль с ]. [14] |
Таким образом, эта кинетическая схема [15] удовлетворительно объясняет основные кинетические особенности реакции независимо от того, рассматривается ли этот процесс в прямом или обратном направлении. Она объясняет также, почему константа k t в работах Ингольда уменьшается по мере протекания реакции и принимает различные значения для растворов переменной концентрации. Правильность предложенного нами механизма была установлена в работе [54], в которой определяли скорости реакции к-бутил-га-бром - бензолсульфоната с хлористым, бромистым и йодистым литием, а также хлористым, бромистым и йодистым тетра-к-бутиламмонием. Во втором столбце таблицы приведены стехиометрические константы второго порядка, рассчитанные по методу Ингольда. В третьем столбце даны бимолекулярные константы скорости реакции между органическим бромидом и ионами С1 -, Вг - и I по механизму, описанному выше. Как отметил Уинстейн [54], поучительно сопоставить эту последовательность с относительными скоростями реакций бромистого метила с ионами галогенов в том же растворителе и при той же температуре в рамках интерпретации кинетики и механизма процесса по Ингольду. [15]
Страницы: 1