Реакция - едкий натр
Cтраница 1
Реакция едкого натра и едкого кали с 4 4 -дихлордифенил-трихлорметилметаном в спиртовом растворе протекает в 67 раз быстрее, чем с 2 4 -изомером, и в 2200 раз быстрее, чем с 2 2 -изомером. На этом основании предложен кинетический метод определения 4 4 -дихлордифенилтрихлорметилметана в техническом продукте и в инсектицидных препаратах. [1]
Количество израсходованного в реакции едкого натра определяется титрованием. [2]
Величина навески зависит от концентрации выделяющегося по реакции едкого натра. [3]
Ввиду того, что сода образуется при реакции едкого натра с бикарбонатом, потребная для добавки в воду доза ее значительно уменьшается. [4]
Ввиду того, что сода образуется при реакции едкого натра в бикарбонатом, ее доза, необходимая для добавки в воду, значительно уменьшается. При высокой концентрации бикарбонатов в воде и невысокой некарбонатной жесткости избыток Na2C03 может остаться в умягченной воде. [5]
Определение альдегидов, основанное на титровании выделившегося по реакции едкого натра, дает хорошие результаты только в тех случаях, когда константы диссоциации образовавшихся продуктов присоединены крайне незначительно. [6]
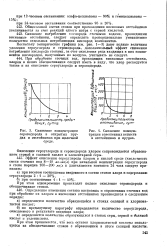 |
Снижение концентрации сероводорода в открытых прудах и отстойниках при щелочной.| Снижение концентрации взвешенных веществ в отстойниках и прудах. [7] |
Общесолевой состав стоков при прохождении вискозных отстойников увеличивается за счет реакций едкого натра с серной кислотой. [8]
На это всегда необходимо обращать виичаиие При восстановлении растворимых в щелочах соединений можно соответственно уменьшить кочичество применяемого в начале реакции едкого натра. Если же реакция идет в нейтральной ити кислой среде, то необходимо постоянно нейтра-чизовать или подкислять смесь Для этой цели приме ияют уксусную, соляную или сорную кислоту, которую в начале реакции можно также добавить в несколько большем кочичестве Однако иногда соли, образующиеся при нейтрализации, действуют как избыток едкого натра, т с вызывают частичное или полное торможение реакции восстановления. [9]
Так как щелочь принимает участие в реакции в стехиометрическом соотношении, то титрометриче-ское определение количества щелочи, применяемой заведомо в избытке, по окончании разрушения галоидоциана, дает возможность судить о количестве вступившего в реакцию едкого натра ( или калия), а следовательно и о количестве галоидоциана во взятой навеске. [10]
Действие едкого натра на кости, жир, крахмал и тому подобные растительные и животные вещества объясняет нам действие его на организмы - Так, кость, опущенная в слабый раствор едкого натра, распадается в порошок и выделяет запах аммиака, что зависит от того, что едкая щелочь изменяет клеевое, органическое ( содержит С, N, Н, О и S. Самые же резкие реакции едкого натра определяются тем, что он насыщает всякие кислоты, образуя с нами соли, которые все почти растворимы в воде, и в этом отношении едкий натр-основание столь же характерное, как азотная кислота между кислотами; натр нельзя открыть посредством образования осадков нерастворимых солей, как это можно сделать для других металлов, многие соли которых мало растворимы. Если раствор солей большинства металлов смешать с едким натром, то образуется растворимая соль натрия и выделяется нерастворимый гидрат [ окиси ] металла, бывшего в соли, напр. Даже многие основные окислы способны с ним самим соединяться и давать растворимые соединения, а потому едкий натр в солях таких металлов производит сперва осадок водной окиси, затем растворяющейся в избытке NaHO. Такое явление происходит, напр. [11]
В другом патенте 5 дается описание превращения по этому же способу ароматических дисульфамидов, с использованием различных количественных соотношений, в отверждающиеся и неотвер-ждающиеся смолы. Показано, что количество введенного в реакцию едкого натра определяет, будет полученная смола отверж-даться при 140 или нет. Продукты используются для покрытий, как прессуемые, заливочные смолы и как клеи. [12]
В другом патенте145 дается описание превращения по этому же способу ароматических дисульфамидов, с использованием различных количественных соотношений, в отверждающиеся и неотвер-ждающиеся смолы. Показано, что количество введенного в реакцию едкого натра определяет, будет полученная смола отверж-даться при 140 или нет. Продукты используются для покрытий, как прессуемые, заливочные смолы и как клеи. [13]
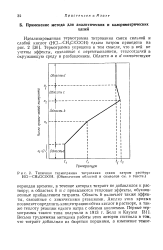 |
Типичная термограмма титрования едким натром раствора НС1 - CHzClCOOH. ( Обозначения областей и символов в тексте. [14] |
Область Ь включает также эффекты, связанные с химическими реакциями. Анализ этих криных позволяет определить концентрацию обеих кислот в растворе, а также теплоту реакции едкого натра с обеими кислотами. [15]
Страницы: 1 2