Реакция - обмен
Cтраница 1
Реакция обмена является суммой двух сопряженных электрохимических процессов, каждый из которых в свою очередь проходит через ряд последовательных стадий. [1]
Реакции обмена между двумя неорганическими соединениями галоидов могут протекать в расплаве или между двумя фазами. Например, введение радиоактивного брома в бромистую сурьму осуществляется изотопным обменом бромом между парообразной бромистой сурьмой и твердым бромистым - 82Вг натрием при высокой температуре. После контакта бромистая - 82Вг сурьма отгоняется. [2]
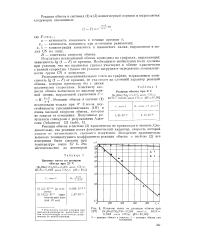 |
Влияние енота на реакцию обмсша при. [3] |
Реакция обмена в системе ( 2) практически не происходит в темноте. Следовательно, эта реакция носит фотохимический характер, скорость которой зависит от интенсивности светового излучения. Вследствие сравнительно высокого температурного коэффициента реакции обмена в системе ( 2) все измерения были сделаны при температуре выше 15 С. [4]
Реакция обмена происходила в течение 15 мин. [5]
Реакции обмена между поглощенными катионами почвы и катионами солевых растворов протекают в эквивалентных соотношениях. При поглощении почвой какого-либо катиона из раствора одновременно из почвы переходит в раствор такое же количество другого катиона. [6]
Реакция обмена между катионами раствора и почвенного поглощающего комплекса заканчивается установлением некоторого подвижного равновесия. Характер обменной реакции ( установление равновесия) в сильной степени зависит от состава и концентрации раствора, его объема, природы обменивающихся катионов и свойств почвы. При изменении состава, количества и концентрации раствора в результате увлажнения или высушивания почвы, внесения удобрений, образования минеральных солей при разложении органического вещества микроорганизмами, выделения С02 и других веществ корнями растений это равновесие смещается, и тогда одни катионы переходят из раствара в поглощенное состояние, а другие из поглощенного состояния - в почвенный раствор. Так, при заделке в почву растворимых солей ( КС1, NH4C1, NaN03 и др.) концентрация почвенного раствора повышается, катионы соли вступают в обменную реакцию с катионами почвенного поглощающего комплекса, часть их поглощается почвой. При усвоении какого-либо катиона растениями концентрация его в растворе снижается, этот катион из поглощенного состояния переходит в раствор в обмен на ионы водорода или другие катионы, находящиеся в почвенном растворе. [7]
Реакции обмена в уксусной кислоте до настоящего времени далеко не полностью исследованы. [8]
Реакция обмена между газообразной двуокисью углерода и бикарбонат-ионами в водном растворе обладает рядом преимуществ, делающих убедительным выбор этой реакции для разделения изотопов углерода. В отсутствии катализатора обмен идет слишком медленно для его практического использования, однако Рейд и Юрэй [14] преодолели эту трудность, применив гетерогенный катализатор и высокое давление. [9]
Реакции обмена ( 1) и ( 2) являются реакциями того же порядка и по отношению к обратным процессам. Реакции же присоединения не являются таковыми, поскольку обратная реакция представляет собой мономолекулярный распад. Для изучения этих систем можно применить методы, изложенные в разд. [10]
Реакции обмена всегда описываются кинетическим уравнением первого порядка, и один опыт не дает информации о порядке реакции или о виде кинетического уравнения. Форму кинетического уравнения определяют из зависимостей констант скорости от парциальных давлений реагентов. [11]
Реакция обмена между H2S и водой идет в жидкой фазе без катализатора. [12]
Реакции обмена в сложных системах, содержащих несколько лигандов и катионов, являются медленными процессами. [13]
Реакции обмена в комплексах, образованных полидентатными лигандами, могут значительно осложняться образованием гетеро-нуклеарных и смешанных комплексов [103], на что необходимо обращать внимание при рассмотрении соответствующих систем. [14]
Реакции обмена, которыми мы занимались в связи с теорией переходного состояния, могут принадлежать к любому из этих типов. [15]
Страницы: 1 2 3 4