Реакция - обмен - кислород
Cтраница 1
Реакция обмена кислорода характерна для сульфоксидов вне зависимости от их строения. Так как такие сульфоксиды, как диметилсульфоксид, подвергаются диме-ризации и диспропорционированию в сульфид и сульфон, то считают, что обмен кислорода осуществляется через четырехчленный цикл, образующийся из двух молекул сульфоксида, как показано на стр. [1]
Реакции обмена кислорода на галогены и другие группы. Альдегиды и кетоны при взаимодействии с РС15 обменивают атом кислорода на два атома хлора, что используется для получения геминальных дихлоралканов ( оба атома хлора присоединяются к одному и тому же атому углерода, стр. [2]
Изучение реакции обмена кислорода неорганических солей дает ценные сведения об относительной прочности связи атомов кислорода с неметаллическими атомами аниона. [3]
Осуществленные исследования реакций обмена кислорода не позволяют определить энергии диссоциации моноокисей, так как дают только разности этих энергий. Для одного из окислов приходится принимать энергию диссоциации, полученную другими методами. [4]
Сопоставление каталитической активности изученных окислов с энергиями активации наиболее надежно для реакции гомомоле-кулярного обмена кислорода, окисления водорода и метана. [5]
Поскольку реакция в водяном газе не достигает равновесия, необходимо, чтобы скорость реакции обмена кислорода была не слишком высокой. В этом случае константы равновесия будут соответствовать квазиравновесному ( стационарному) состоянию, с которым часто встречаются при изучении кинетики цепных реакций. Возможно и более простое объяснение, если принять во внимание такой дополнительный фактор, как диффузию в порах, хотя влияние размеров частиц и концентрации инертного газа в этом случае не проявляется. [6]
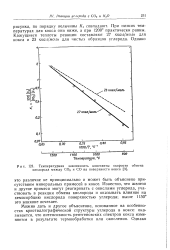 |
Температурная зависимость константы скорости обмена кислорода между СО2 и СО на поверхности кокса. [7] |
Известно, что железо и другие примеси могут реагировать с окислами углерода, участвовать в реакции обмена кислорода и оказывать влияние на хемосорбцию кислорода поверхностью углерода; выше 1150 это влияние исчезает. [8]
Обмен кислорода и рацемизация сульфоксидов могут протекать также под действием ЫзО4 [7, 130]; при этом скорости реакций обмена кислорода и рацемизации также равны. [9]
Однако наши данные показали, что из двух одновременно идущих реакций - взаимодействия перекиси водорода с иодатом калия и реакции обмена кислорода иодата калия с водой - первая идет заметно быстрее и приводит к тому, что иодат калия в процессе взаимодействия с перекисью водорода приобретает кислород последней. [10]
Эти простые схемы могут требовать видоизменений, так как обнаруживается много различий в поведении разных окисей при различных методах приготовления или предварительной обработки и при разных температурах. Винтер [167, 168] изучил реакции обмена кислорода, окиси углерода и углекислоты с О18 на окисных катализаторах и привел реакции, отличные от указанных выше. Кроме того, Винтер показал, что реакция происходит на небольшом числе центров, а не на всей поверхности. Вайнштейн и Туровский [163] нашли, что на поверхности окиси хрома обмен с О18 происходит в незначительной степени, и пришли к выводу, что реакция не идет путем попеременного восстановления и окисления. Однако эти исследования не дают бесспорных доказательств, если неизвестно, какая часть центров поверхности активна для каталитической реакции, так как интенсивная реакция на немногих центрах должна приводить к малому обмену, тогда как при той же интенсивности реакции, но на большом числе центров обмен должен быть значительным. [11]
По мнению Паскоуна [41], это связано с малой подвижностью поверхностного кислорода, с его низкой способностью к активированной адсорбции на этом окисле. Это проявляется, в частности, в низкой скорости реакции изотопного гомомолекуляр-ного обмена кислорода. [12]
Изменение наклона кривой на графике k3 [ Ci от обратной температуры позволяет предположить, что концентрация активных центров [ С ( ] на поверхности частиц кокса уменьшается с температурой. Менее определенны данные постепенного уменьшения энергии активации образования кислородных комплексов СХОУ, поскольку оно будет следствием увеличения теплоты реакции обмена кислорода при высоких температурах. [13]
Это уравнение является схемой процесса обмена кислорода между газовой и твердой фазами, а не выражением переноса углерода из твердой фазы в газовую. Экспериментально доказано, что реакции обмена кислорода можно достаточно надежно сопоставлять с реакциями, в которых происходит перенос углерода. [14]
Оба типа реакций идут исключительно путем расщепления связи фосфор - кислород. Каждая реакция состоит из двух конкурирующих реакций, одна из которых соответствует расщеплению пяти-членного цикла, а другая - отщеплению ациклической алкоксильной группы с сохранением цикла. Вторая из этих реакций аналогична реакции обмена кислорода в циклических диэфирах фосфорной кислоты. Таким образом, при щелочном и кислотном гидролизе триэфиров ускоряющее действие, обусловленное наличием цикла, сказывается и на реакции раскрытия цикла, и на реакции гидролиза ациклической оксигруппы. Все эти результаты соответствуют теории Уэстхеймера, которая уже излагалась на примере диэфиров фосфорной кислоты. [15]
Страницы: 1