Реакция - образование - метан
Cтраница 2
Подробные данные об исследовании равновесия реакции образования метана из углерода и водорода помещены в главе X и поэтому здесь не приводятся. [16]
Каков бы ни был детальный механизм реакции образования метана из ацетилена, она без сомнения имеет гетерогенную природу. Если на пути взрывной волны при разложении ацетилена поместить материал с большой поверхностью, распространение взрыва замедляется или полностью прекращается, а основным продуктом реакции становится метан, а не водород ( см. гл. Как было отмечено выше, значительная скорость превращения С2Н2 в СН4 при пиролизе этана наблюдалась в присутствии поверхности корунда. В случае же кварца основными продуктами превращения ацетилена в системе крекируемого этана становятся водород и кокс, а скорость суммарного превращения ацетилена снижается в 20 раз. [17]
 |
Схема расчета теплового эффекта реакции образования СН4 по теплотам сгорания СН4, С и Н2. [18] |
Согласно закону Гесса, тепловой эффект реакции образования метана из углерода и водорода не зависит от того, в одну или несколько стадий осуществляется эта реакция. Таким образом, искомая величина ДЯ может быть определена как алгебраическая сумма тепловых эффектов первой и второй стадий дпухстадий-иого процесса. Как видно из предыдущего, тепловые эффекты этих стадий имеют разные знаки, поэтому при их суммировании никак не может получиться такая большая величина, как 1856 кДж / моль. [19]
 |
Схема расчета теплового эффекта реакции образования СН4 по теплотам сгорания СН4, С и Н2. [20] |
Согласно закону Гесса, тепловой эффект реакции образования метана из углерода и водорода не зависит от того, в одну или несколько стадий осуществляется эта реакция. Таким образом, искомая величина ДЯ может быть определена как алгебраическая сумма тепловых эффектов первой и второй стадий двухстадий-ного процесса. Как видно из предыдущего, тепловые эффекты этих стадий имеют разные знаки, поэтому при их суммировании никак не может получиться такая большая величина, как 1856 кДж / моль. [21]
Практика газификации под давлением показывает, что реакция образования метана самая медленная. [22]
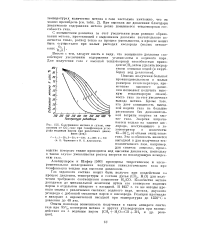 |
Содержание метана в сухом, очищенном от ССЬ газе при газификации углерода водяным паром при различных давле. [23] |
С повышением давления за счет увеличения роли реакции образования метана, протекающей с выделением довольно значительного количества тепла, расход тепла на процесс уменьшается, и процесс може. [24]
Все эти затраты, составляющие в случае реакции образования метана более 2000 кДж / моль, должны быть компенсированы за счет энергии, выделяющейся при образовании четырех связей углерод - водород. Компенсация действительно происходит ( реакция оказывается еще и экзотермической), но лишь при условии, что образуются четыре связи С - Н, Основным продуктом взаимодействия водорода с углеродом и является метан. [25]
Изменения свободной энергии на один углеродный атом углерода в реакции образования метана более отрицательны, чем в реакциях образования высших углеводородов. Ниже 500 реакции образования углерода ( графита) имеют менее отрицательные изменения свободной энергии, чем реакция образования метана, но более отрицательные, чем реакции образования высших углеводородов. [26]
Примером применения третьего закона термодинамики может служить расчет равновесия реакции образования метана из элементов С ( графит) 2Н2 ( г) СН4 ( г), для которойДЯ 73 - 21 045ккал ( 88ЗкДж), абсолютные энтропии СН4, Н2 и графита при 873 К составляют 56 6 ( 237 5), 38 9 ( 163 2) и 4 8 кал / ( моль - К) [ 20 8 Дж / ( моль К) ] соответственно. [27]
Из других реакций, происходящих в реакционной зоне, необходимо указать на реакцию образования метана СН4 в результате контакта свободного водорода Н2с раскаленным углеродом С; С 2Н2 СН 1723 ккал и на реакцию восстановления окиси углерода СО из углекислоты СО2 в условиях недостатка кислорода; СО2 С 2СО - 3233 ккал. [28]
Рутений, который при атмосферном давлении и сравнительно высоких температурах является хорошим катализатором реакции образования метана, при высоких давлениях ( от 100 до 1000 атм) и при температурах ниже 200 С способствует получению высокомолекулярных парафиновых углеводородов. [29]
 |
Содержание основных элементов в исследованных сталях. [30] |
Страницы: 1 2 3 4