Реакция - образование - соединение
Cтраница 1
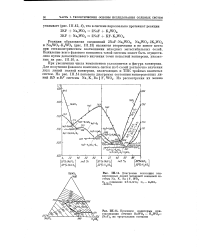 |
Диаграмма состояния конверсионных линий четверной взаимной системы Na, К, Ва F, W04.| Проекция политермы кри - f сталлизации сечения BaW04 - K2W04 - SZB ( NaF2 на треугольник составов. [1] |
Реакции образования соединений 2NaF - Na2W04, Na2W04 - 2K2W04 и Na2W04 - K2W04 ( рис. III.13) являются вторичными и не имеют места при стехиометрическом соотношении исходных метастабильных солей. [2]
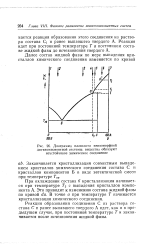 |
Диаграмма плавкости неизоморфной. [3] |
Реакция образования соединения С из раствора состава С и ранее выпавшего твердого А идет, как и в предыдущем случае, при постоянной температуре Т и заканчивается после исчезновения жидкой фазы. [4]
Реакция образования соединения иода с водородом - йодистого водорода HJ - протекает только при сильном нагревании, является обратимой и не идет до конца. Свойства йодистого водорода приведены ниже. [5]
Реакцию образования оловых соединений из гидроксо - или аквакомплексов иногда называют оляцией, а процесс получения оксосоединений из гидроксо -, аква - или оловых соединений - оксоляцией. [6]
Реакцией образования соединения XT в результате взаимодействия радикала Х - с атомами трития вещества RT можно прене-бречь, так как удельная активность RT достаточно высока и концентрация его не превышает 10 - 6 мол. [7]
Если реакция образования соединения из простых веществ происходит в газовой фазе, то, в соответствии с законом Гесса, энтальпия образования соединения, определяется изменением энергии при диссоциации и образовании химических связей простых веществ и соединения. Это позволяет рассчитывать энергию связей по энтальпиям образования соединений. [8]
 |
Эитальпийиая диаграм. [9] |
Если реакция образования соединения из простых веществ происходит в газовой фазе, то, в соответствии с законом Гесса, энтальпия образования соединения, определяется изменением энергии при диссоциации и образовании химических связей простых веществ и соединения. Это позволяет рассчитывать энергию связей по энтальпиям образования соединений. [10]
Если реакция образования соединения из элементов сопровождается выделением тепла из системы в окружающую среду, то энтальпии образования этого соединения A. И наоборот, если система поглощает тепло из окружающей среды, энтальпии образования соединения из элементов обычно приписывают положительный знак. Для полного энергетического описания реакции необходимо учитывать температуру и агрегатное состояние исходных и конечных веществ. Согласно международному соглашению, энтальпии элементов в их стандартном состоянии ( A - ff / 0) при всех температурах приняты равными нулю. В табл. III.1 приведены энтальпии образования из элементов некоторых важных соединений. [11]
Если реакция образования соединения из элементов сопровождается выделением тепла из системы в окружающую среду, то энтальпии образования этого соединения A. И наоборот, если система поглощает тепло из окружающей среды, энтальпии образования соединения из элементов обычно приписывают положительный знак. Для полного энергетического описания реакции необходимо учитывать температуру и агрегатное состояние исходных и конечных веществ. Согласно международному соглашению, энтальпии элементов в их стандартном состоянии ( A - ff / 0) при всех температурах приняты равными нулю. В табл. III.1 приведены энтальпии образования из элементов некоторых важных соединений. [12]
Параметры реакций образования соединений из свободных атомов элементов или обратных им процессов - атомизации ( см. § 8) должны и в методах сравнительного расчета находиться между собой в более простых соотношениях, чем параметры рассмотренных выше ( § 25 и 26) реакций образования из простых веществ, так как при сопоставлении их отпадает искажающее влияние различия агрегатного состояния простых веществ и различия энергии связи между атомами в молекулах простых веществ. [13]
Расчет реакций образования соединений из элементов наиболее прост, поскольку М и N для элементов равны нулю. Это видно на следующем примере образования окиси ниобия. [14]
Гиббса реакции образования соединения МаХь из элементов ( C brE0); E - потенциал растущего слоя, измеренный на металлических контактах; т - валентность аниона; Ъ - стехиометрический коэффициент в формуле МаХь; q - заряд электрона; / - толщина слоя продукта. [15]
Страницы: 1 2 3 4