Реакция - образование - комплексное соединение
Cтраница 3
Еще в большей мере значение комплексных соединений для анализа связано с тем обстоятельством, что реакции образования комплексных соединений являются нередко весьма чувствительными и специфическими реакциями на отдельные ионы. [31]
Термометрическое титрование применяется при изучении реакций комплексообразования, а также при определении ионов металлов путем измерения тепловых эффектов реакций образования комплексных соединений. В последнем случае обычно выделяют катионы металлов из раствора в виде нерастворимого соединения или используют реакции образования растворимых анионных комплексов. В некоторых случаях эти реакции протекают последовательно. Примером последнего может служить метод определения серебра по реакции ионов серебра с цианид-ионами. Образующийся вначале нерастворимый цианид серебра затем растворяется в избытке цианида калия, образуя ион дициапида серебра. [32]
Некоторые стабилизаторы, особенно оловоорганические соединения, ингибируют дегидрохлорирование ПВХ путем блокирования полимерных активных центров, реакций со свободными радикалами или реакций образования комплексных соединений с каталитически активными примесями. Возможность блокирования активных центров доказана также для определенных металлических мыл. Ингиби-рование отщепления НС1 служит одним из путей стабилизации окраски ПВХ. [33]
Тем не менее эти опыты были полностью закончены, так как предполагали, что они во всяком случае будут способствовать более глубокому изучению реакции образования комплексных соединений мочевины. [34]
В химическом анализе, как известно, используют четыре типа химических реакций: 1) кислотно-основные реакции; 2) реакции окисления-восстановления; 3) реакции образования комплексных соединений и групп; 4) реакции осаждения и другие реакции образования новых фаз. [35]
Метод основан на избирательном сплавлении свободной двуокиси кремния со смесью бикарбоната и хлорида натрия, растворении полученного силиката натрия и определении ионов кремния в растворе по реакции образования кремнемолибденового комплексного соединения. [36]
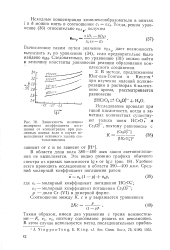 |
Зависимость величины молярного коэффициента погашения от концентрации при различных длинах волн в случае невыполнения основного закона све-топоглощения. [37] |
Вычисленное таким путем значение SBA дает возможность вычислить Xi по уравнению ( 34), если предварительно было найдено ЕНА - Следовательно, по уравнению ( 31) можно найти и величину константы равновесия реакции образования комплексного соединения. [38]
Как правило, при использовании кинетических методов анализа определяют равновесную, а не общую концентрацию вещества, поэтому указанные методы с успехом можно применять при изучении равновесий в растворах и, в особенности, при изучении равновесий реакций образования комплексных соединений. [39]
Методами комплексометрии можно количественно определ разные катионы ( Ag, Hg2, A13 и др.) и анионы ( CN -, F С1 - и др.), склонные вступать в реакции комплексообразован ] Особое положение среди методов комплексообразования заним так называемая комплексометрия, основанная на применен реакций образования прочных комплексных соединений с HI рилотриуксусной, этилендиаминтетрауксусной и другими амш поликарбоновыми кислотами, дающими прочные комплексн соединения с Са2, Mg2, Zn2 и другими катионами. Указанн соединения называют комплексонами. [40]
ЭДТА), занимающий три или шесть координационных мест ( хелатный эффект, см. разд. Реакцию образования очень прочных комплексных соединений щелочноземельных, редкоземельных и других металлов с ЭДТА используют в химическом анализе и других областях. [41]
Хлорид серебра растворим в растворах аммиака и тиосульфата натрия. Составить уравнения реакций образования комплексных соединений серебра, учитывая, что координационное число иона Ag равно двум. [42]
Другая классификация методов химического анализа основана на ином критерии, а именно на типе химической реакции. Различают кислотно-основные реакции, реакции образования комплексных соединений и реакции окисления - восстановления. [43]
Из литературных данных известно, что оксикислоты дают комплексные соединения с рением, имеющим валентность ниже семи. При изучении влияния оксикислот на реакцию образования комплексного соединения рения с а-фурилдиокси-мом было установлено2, что максимальная окраска соединения развивается в течение 15 мин, без добавления оксикислот для этого необходимо 45 мин. Видимо оксикислоты ( щавелевая или винная), фиксируя определенное валентное состояние рения ( IV), способствуют более быстрому образованию соединения рения с а-фурилдиоксимом. Следует отметить, что при определении рения в присутствии больших количеств молибдена с добавлением оксикислоты ( винной) оптическая плотность комплексного соединения рения понижается, достигая постоянного значения так же через 15 мин. [44]
Оксикислоты образуют комплексные соединения с рением, имеющим степень окисления ниже семи. При изучении влияния оксикислот на реакцию образования комплексного соединения рения с а-фурилдиоксимом было установлено [52], [53], что максимальная окраска в их присутствии развивается в течение 15 мин; без добавления оксикислот необходимо 45 мин. Видимо, оксикислоты ( щавелевая или винная), фиксируя определенную степень окисления рения ( IV), ускоряют образование соединения рения с а-фурилдиоксимом. При определении рения в присутствии больших количеств молибдена с добавлением винной кислоты рекомендуется использовать вариант дифференциального метода ( стр. [45]
Страницы: 1 2 3 4