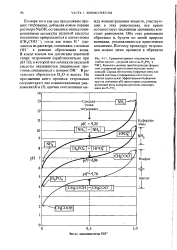
Реакция - образование - вода
Cтраница 3
По мере того как мы продолжаем процесс титрования, добавляя новые порции раствора NaOH, оставшиеся недиссоциированными молекулы уксусной кислоты постепенно превращаются в ацетат-ионы ( СН3СОО -), тогда как ионы Н удаляются из раствора, соединяясь с ионами ОН - в реакции образования воды. В результате образуются Н2О и ацетат. [32]
Показано, что истинно-электрогазовыми процессами, зависящими от существующего режима в разряде, являются реакции образования и разложения перекиси водорода. Реакция образования воды из водорода и кислорода является каталитической реакцией, зависящей от природы поверхности электродов. [33]
Например, реакция образования воды записывается уравнением 2Ш Оа 2Н20, показывающим, что две молекулы водорода, соединяясь с одной молекулой кислорода, дают две молекулы воды. Заменяя формулы грамм-молекулярными количествами веществ определяют весовые соотношения между участвующими в реакции веществами. [34]
Например, реакция образования воды записывается уравнением 2Ш Оа 2НгО, показывающим, что две молекулы водорода, соединяясь с одной молекулой кислорода, дают две молекулы воды. Заменяя формулы грамм-молекулярными количествами веществ определяют весовые соотношения между участвующими в реакции веществами. [35]
Например, реакция образования воды записывается уравнением 2Ш 02 ЗШО, показывающим, что две молекулы водорода, соединяясь с одной молекулой кислорода, дают Две молекулы воды. Заменяя формулы грамм-молекулярными количествами веществ определяют весовые соотношения между участвующими в реакции веществами. [36]
 |
Водородно-кислородный гальванический элемент. [37] |
Левый электрод омывается потоком пузырьков водорода, а правый - кислорода. В этом элементе реакция образования воды разделена на две части. [38]
Теория электролитической диссоциации Аррениуса объясняет кислотные свойства растворов присутствием ионов водорода, а основные - ионов гидроксила. Нейтрализация рассматривается как реакция образования воды и соли. Поскольку степень диссоциации может быть определена посредством измерения электропроводности, то сила кислот и оснований сопоставляется по их электропроводности. Эти представления иногда называют водной теорией кислот и оснований или теорией их электролитической диссоциации. [39]
Реакция практически протекает только при нагревании. С повышением температуры скорость реакции образования воды увеличивается. [40]
Очищаемый водород должен содержать не более 2 % ( объемн. При больших количествах кислорода выделяющееся в ходе реакции образования воды тепло может вызвать недопустимо высокий разогрев катализатора. [41]
Нейтрализация слабой кислоты или слабого основания сопровождается одновременно их диссоциацией с тепловым эффектом ЛЯДИСс, знак и величина которого зависят от природы электролита. Поэтому теплота нейтрализации в этом случае отличается от теплоты реакции образования воды из ионов. Например, теплота нейтрализации HCN раствором NaOH равна - 10 29 кДж / моль. [42]
Большое влияние на скорость химических реакции оказывает температура. Например, экспериментальные данные показали, что при комнатной температуре реакция образования воды из водорода и кислорода не идет - ее скорость равна нулю; при 400 С она протекает очень медленно, при 500 С гораздо быстрее, а при 600 С осуществляется мгновенно, со взрывом. [43]
Таким образом, обратимые реакции являются таковыми во всем интервале температур, при которых вообще могут существовать рассматриваемые вещества. Практически же обратимость заметна лишь в некотором более узком интервале, например для реакции образования воды ( под обычным давлением) между 2000 и 4000 С. [44]
Таким образом, в действительности обратимые реакции являются таковыми во всем интервале температур, при которых вообще могут существовать рассматриваемые вещества. Практически же обратимость заметна лишь в некотором более узком интервале, например для реакции образования воды ( под обычным давлением) между 2000 и 4000 С. [45]
Страницы: 1 2 3