Реакция - образование - йодистый водород
Cтраница 1
Реакция образования йодистого водорода проводится путем одновременного введения в камеру реагентов и вывода из камеры продукта при давлениях газов, равных ( бесконечно близким) их равновесным парциальным давлениям. Для этого движением поршней в цилиндрах исходные давления газов Н и J2 предварительно и давление HJ после вывода из камеры доводятся до равновесных. Размеры камеры принимаются столь большими, что при введении в нее по 1 молю реагентов и удалении 2 молей продукта равновесная их концентрация не изменяется. Введение реагентов и извлечение продукта под равными давлениями газов как вне, так и внутри камеры работой не сопровождается. [1]
Реакция образования йодистого водорода Я2 J2 7 2HJ протекает в сосуде объемом V 1 м3 при температуре Т 693 К. [2]
При реакции образования йодистого водорода система состоит из молекул водорода, иода и йодистого водорода, а также из взаимодействия между ними, заключающегося в разрыве, образовании или изменении химических связей и сопутствующих чтим процессам изменений энергии, в данном случае - поглощения тепла. [3]
При реакции образования йодистого водорода система состоит из молекул водорода, иода и йодистого водорода, а также из взаимодействия между ними, заключающегося в разрыве, образовании или изменении химических связей и сопутствующих этим процессам изменений энергии, в данном случае - поглощения тепла. [4]
При реакции образования йодистого водорода система состоит из молекул водорода, иода и йодистого водорода, а также из взаимодействия между ними, заключающегося в разрыве, образовании или изменении химических связей и сопутствующих чтим процессам изменений энергии, в данном случае - поглощения тепла. [5]
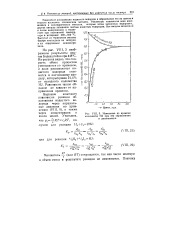 |
Изменение во времени. [6] |
Выразим константу равновесия реакции образования йодистого водорода через парциальные давления по уравнению ( VIII, 9), а также через концентрации и числа молей. [7]
Таким образом, несмотря на двухстадийность, реакция образования йодистого водорода может быть описана, как предполагавшаяся ранее одностадийная, с общей константой скорости, равной произведению константы равновесия диссоциации иода на константу скорости второй стадии реакции. [8]
Больше всего энергии выделяется при соединении фтора с водородом, реакция образования йодистого водорода является даже эндотермической. Фтор с водородом соединяется в темноте без нагревания со взрывом, а йод с водородом - только при нагревании выше 200 С, и реакция является обратимой. [9]
Больше всего энергии выделяется при соединении фтора с водородом, реакция образования йодистого водорода является даже эндотермической. Фтор с водородом соединяется в темноте без нагревания со взрывом, а иод с водородом - только при нагревании выше 200 С, и реакция является обратимой. [10]
Больше всего энергии выделяется при соединении фтора с водородом, а реакция образования йодистого водорода является даже эндотермической. Фтор с водородом соединяются со взрывом в темноте и без нагревания, а иод с водородом только при нагревании. [11]
Лемуан изучал реакцию образования йодистого водорода из паров иода и водорода и установил, что при 265 С ( масляная баня) время, необходимое для установления равновесия, исчисляется месяцами, при 350 С ( кипящая ртуть) - днями, при 440 С ( кипящая сера) - часами. Он нашел, что состояние равновесия этой системы не зависит от давления. [12]
Втгяянйе нагревания на скорость реакции в основном определяется ростом константы скорости k, так как температура на концентрацию не влияет. В табл. 17 в качестве примера приводятся данные по изменению величины константы скорости реакции образования йодистого водорода с температурой. [13]
Гесса, как это показано в соответствующем разделе. Можно видеть, что реакции образования фтористого водорода, хлористого водорода и бромистого водорода экзотермичны, тогда как реакция образования йодистого водорода эндотермична. Даже по отношению к парам иода эта реакция является лишь слабо экзотермичной. [14]
В первую очередь необходимо внимательно изучить уравнение реакции и отметить соответствующим индексом физическое состояние каждого вещества, с тем чтобы не сделать ошибки при написании выражения для константы равновесия. Например, в реакции образования йодистого водорода может использоваться как твердый, так и газообразный иод. [15]
Страницы: 1 2