Реакция - окисление - сульфит
Cтраница 2
Астарита и др. 3 указывают на возможные трудности и Ошибки при использовании реакции окисления сульфита для определения межфазной поверхности. По-видимому, в ходе реакции на поверхности жидкости может образовываться жесткий поверхностный слой. Это оказывает влияние на абсорбционный процесс, уменьшая эффективную поверхность. Такое явление может наблюдаться, например, при работе с ламинарными струями или в ячейках с мешалкой, погруженной в глубь жидкости. [16]
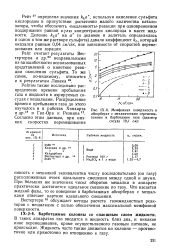 |
Межфазная поверхность в абсорберах с механическим перемешиванием и барботажем газа ( диаметр сосуда 19 1 см. [17] |
Рейт считает результаты Вес-тертерпа и др. 62 неправильными из-за ошибочности использованных представлений о кинетике реакции окисления сульфита. [18]
Он представил реакцию окисления сульфита натрия как серию процессов, в которых окисление одной молекулы вызывает превращение другой. [19]
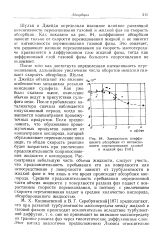 |
Зависимость коэффициента абсорбции от интенсивности перемешивания газовой и жидкой фаз. [20] |
После того как достигнута определенная интенсивность перемешивания, дальнейшее увеличение числа оборотов мешалки снижает скорость абсорбции. Шульц и Джейдн объясняют это явление / м-ю особенностью механизма реакции окисления сульфита. Как уже было сказано выше, окисление обычно ведут в присутствии сульфата меди. После прибавления катализатора сначала наблюдается индукционный период, когда повышается концентрация промежуточных продуктов. Если предположить, что образование промежуточных продуктов зависит от концентрации кислорода, который обусловливает переокисление иона меди, то общая скорость реакции будет возрастать при увеличении продолжительности соприкосновения жидкости с кислородом. Рассматривая небольшую часть объема жидкости, следует учесть, что продолжительность пребывания его на поверхности или непосредственно у поверхности зависит от турбулентности в жидкой фазе и что лишь в это время происходит абсорбция кислорода. Средняя продолжительность пребывания определенной части объема жидкости у поверхности раздела фаз падает с возрастанием скорости перемешивания, и поэтому с увеличением скорости перемешивания падает и среднее количество кислорода, абсорбированного жидкостью. [21]
Выделяющийся молекулярный иод образует с присутствующим в растворе крахмалом соединение, окрашивающее раствор в синий цвет. Появление синей окраски указывает на начало второй реакции и на конец первой. Так как реакция окисления сульфита иодатом протекает довольно медленно, время ее протекания можно измерить с помощью секундомера, считая началом реакции момент приливания сульфита натрия к раствору иодата, а концом - появление синей окраски. [22]
Выделяющийся молекулярный иод образует с присутствующим в растворе крахмалом соединение, окрашивающее раствор в синий цвет. Появление синей окраски указывает на начало второй реакции и на конец первой. Так как реакция окисления сульфита иодатом протекает довольно медленно, время ее протекания можно измерить с помощью метронома или секундомера, считая началом реакции момент приливания сульфита натрия к раствору иодата, а концом - появление синей окраски. [23]
Любопытно, что такое повышение способности окисляться кислородом воздуха происходит не только при оксидиметриче-ских титрованиях, но и при совсем других реакциях, например, при титрованиях методом нейтрализации. Рашиг 2 нашел, например, что при нейтрализации бисульфита едким натром значи-тельно большее его количество превращается в сульфат, чем окислилось бы нормального сульфита ( легче окисляемого) при стоянии его раствора на воздухе такое же время. Он показал, что такое же повышение происходит и при обратном процессе превращения сульфита в бисульфит. Совершенно такая же индукция происходит и при реакции окисления сульфита или бисульфита иодом. Хотя обычно говорят, что иод каталитически ускоряет окисление сульфита кислородом воздуха, но в действительности реакция между сульфитом и кислородом здесь индуцируется другой более быстрой реакцией. [24]
Страницы: 1 2