Реакция - мягкое окисление
Cтраница 1
Реакция мягкого окисления изомерных токоферолов в токоферолхино-ны, количественно протекающая с раскрытием пиранового цикла, лежит в основе важнейших методов их аналитического определения в природных продуктах. В данном случае окисление хлорным железом ведут в присутствии о-фенантролина или а, а - дипиридила [45], являющихся индикаторами. [1]
В реакциях мягкого окисления лучшими катализаторами являются окислы: Cu20, Ag20, V205, Mo03, обладающие низкой симметрией. Возможно, что в этом случае справедливы представления, рассмотренные в главе 3, § 2, о связи активности ( и селективности) с типом решетки. Для этих реакций более вероятна первоначальная адсорбция кислорода в виде молекулы и последующее взаимодействие с ним углеводорода. Адсорбция углеводорода поверх кислорода, возможно, является лимитирующей стадией в случае мягкого окисления. [2]
 |
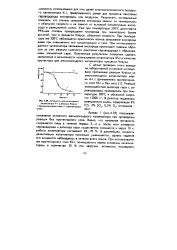
Связь каталитической активности А окислов металлов с числом незаполненных d - уровней в катионах решетки. [3] |
Для образования комплекса с олефинами необходимо наличие в катализаторе иона металла, который мог бы осуществить этот процесс. Однако корреляции скоростей реакции мягкого окисления с устойчивостью комплексов различных металлов с олефинами не наблюдается. По-видимому, такие комплексы не являются определяющими промежуточными формами неполного окисления углеводородов, а в лимитирующей стадии процесса принимает участие кислород с образованием кислород-углеводородных комплексов. Поэтому для подбора катализаторов мягкого окисления необходимо обратить внимание на характер связи кислорода с катализатором и на его реакционную способность. [4]
По акцепторной способности катионов исследованные окислы отличаются не более чем в 3 - 4 раза. В пределах одного порядка изменяется также активность катализаторов в отношении реакции глубокого окисления; в реакции мягкого окисления диметилсульфида это различие больше. [5]
К биологически активным napa - хинонам относится окисленная форма иродных 6-оксихроманов - токоферолов, или витаминов группы Е и. Для важнейшего витамина этой группы - токоферола ( XXXVI) - такой окисленной формой является а-токоферол - [ нон ( XXXVII), производное 2 3 5-триметилбензохинона, который полу-ется в результате реакции мягкого окисления а-токоферола хлорным же-зом или хлорным золотом. [6]
Это связывают с тем, что в условиях реакции сернистые соединения превращаются в SC2, которая прочно хемосорбируется или образует поверхностные сульфаты ( см. гл. При окислении тиоэфира дезактивация окислов также может происходить из-за превращения их в сульфаты. Как уже отмечалось выше ( см. табл. 125), сульфаты неактивны в реакциях мягкого окисления диметилсульфида и ускоряют в основном только глубокое окисление. При глубоком окислении тиоэфира выделяется SCb, способная в определенных условиях взаимодействовать с окислами металлов, превращая их в сульфаты ( см. гл. Кроме того, сульфатная сера составляет лишь небольшую часть общей серы, содержащейся в отравленных катализаторах. [7]
Как отмечалось выше, при контактном окислении реакция нередко выходит в объем между зернами катализатора, и некоторая часть исходного органического вещества и промежуточных продуктов подвергается гомогенным окислительным превращениям. В отсутствие гетерогенного катализатора состав продуктов гомогенного окисления углеводородов в газовой фазе в сильной степени зависит от температуры и концентрации кислорода. При относительно невысоких температурах ( до 300 С) и некотором избытке кислорода преобладают реакции мягкого окисления, сопровождающиеся образованием кислородсодержащих веществ. С повышением температуры усиливается деструктивное окисление; в этих условиях кислородные производные с удовлетворительным выходом получают за счет сокращения времени контакта. Выше 600 С, особенно при недостатке кислорода, превалируют реакции окислительного распада - и дегидрирования. Механизм окислительной деструкции углеводородов в этих условиях хорошо согласуется с положением [4] о конкуренции бимолекулярных превращений промежуточных гидропере-кисных радикалов с термическими мономолекулярными реакциями распада. [8]
Для мягкого окисления необходимы носители с малой удельной поверхностью, так как чем больше поверхность, тем больше узких пор, в которых разрушаются кислородсодержащие продукты реакции. В результате многочисленных работ по приготовлению носителей удалось научиться регулировать дисперсность частиц и размеры пор, создавая заданную структуру подложки. О применении носителей с большой поверхностью для реакций мягкого окисления углеводородов в литературе достаточно надежных данных не имеется. [9]
Эти результаты свидетельствуют о важной роли продуктов глубокого окисления в процессе дезактивации катализатора и показывают, что, вероятно, различные окислы дезактивируются вследствие взаимодействия с одним и тем же ядом. При окислении диметилсульфида на МпО2 за время двукратного уменьшения удельной активности катализатора в отношении сульфокси-да и сульфона образуется на порядок меньше продуктов глубокого окисления ( 0 02 - 10 - 3 моль / м2), чем на других окислах. Это отклонение может быть вызвано тем, что либо катализатор отравляется другим ядом, либо первоначальный яд ( СН35Оз - фрагмент) доокисляется активным кислородом поверхности, превращаясь в сульфат, неспособный ускорять реакцию парциального окисления. Наблюдаемая закономерность объясняется тем, что устойчивость катализатора определяется соотношением скоростей реакции мягкого окисления ( W lt) и процесса дезактивации. [10]
 |
Активность алюмооксидного. [11] |
Результаты исследований показали, что степень связывания кислорода зависит от температуры и объемной скорости и не зависит от исходной концентрации кислорода в реакционной смеси. Уже при температуре 250 С достигается 99 % - ная степень превращения кислорода при значительно более высокой, чем в процессе Клауса, объемной скорости. При температуре же 300 С наблюдается практически полное связывание кислорода даже при повышенных его концентрациях в газе. При использовании данного катализатора связывание кислорода происходит главным образом за счет реакции мягкого окисления сероводорода с образованием элементной серы. [12]
Страницы: 1