Реакция - каталитическое окисление - окись - углерод
Cтраница 1
Реакция каталитического окисления окиси углерода изучалась довольно интенсивно, прежде всего, как одна из простейших реакций, удобная для установления основных закономерностей окислительного катализа. Кроме того, эта реакция важна и в практическом отношении в связи с необходимостью решения проблемы очистки выхлопных газов двигателей внутреннего сгорания, выбросных и вентиляционных газов от окиси углерода. Наконец, рассматриваемая реакция благодаря своему высокому тепловому эффекту представляет интерес и как источник тепла. [1]
 |
Схема газоискателя Института охраны труда. [2] |
Прибор построен на принципе измерения теплового эффекта реакции каталитического окисления окиси углерода в углекислоту. Исследуемый воздух проходит через специальную реакционную камеру, разделенную на две части. В верхней части ее происходит окисление окиси углерода на катализаторе ( гопкалит), которым заполнена эта часть камеры. [3]
Принцип действия прибора основан на измерении теплового эффекта реакции каталитического окисления окиси углерода до двуокиси углерода. [5]
 |
Газоанализатор ТХ-2104. [6] |
Принцип действия прибора основан на измерении теплового эффекта реакции каталитического окисления окиси углерода до цвуокиси углерода. [7]
Принцип действия прибора основан на измерении теплового эффекта реакции каталитического окисления окиси углерода до двуокиси углерода. [8]
Газоанализатор ТХ-2102 построен на принципе измерения полезного теплового эффекта реакции каталитического окисления окиси углерода до двуокиси. [9]
Для определения окиси углерода с успехом применяют термохимические газоанализаторы, построенные на принципе измерения теплового эффекта реакции каталитического окисления окиси углерода до двуокиси. Для определения паров ртути в воздухе применяют прибор, основанный на поглощении парами ртути ультрафиолетового излучения и измерении величины этого поглощения фотоэлектрическим устройством. [10]
Для определения окиси углерода с успехом используют термохимические газоанализаторы, действие которых основано на принципе измерения теплового эффекта реакции каталитического окисления окиси углерода до двуокиси. Для определения паров ртути в воздухе применяют приборы, работа которых основана на поглощении резонансной линии ртути с длиной волны 253 7 нм. [11]
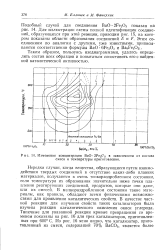 |
Изменение концентрации ВаО 2Fe2O3 в зависимости от состава смеси и температуры приготовления. [12] |
Нередки случаи, когда вещества, образующиеся путем взаимодействия твердых соединений в отсутствие каких-либо плавких материалов, получаются в очень тонкораздробленном состоянии, если температура их образования значительно ниже точки плавления реагирующих соединений, продуктов, которые они дают, или их смесей. В мелкораздробленном состоянии такие материалы, как правило, обладают всеми физическими возможностями для проявления каталитических свойств. В качестве частной реакции для изучения свойств таких катализаторов была изучена реакция каталитического окисления окиси углерода. Типичные для указанной реакции кривые превращения со временем показаны на рис. 16 для трех катализаторов, приготовленных при 600 С. [13]
Эта же реакция разложения на окислах n - типа ( например, на ZnO) сопровождается уменьшением электропроводности катализатора. Кроме того, Бейкер и Дженкинс указали, что результаты опытов по введению в окислы добавок ( см. разд. Теперь обратимся к сопоставлению каталитической активности полупроводниковых окислов в процессе окисления окиси углерода. Шваб [ 97 показал, что характер дефектов ( электронные свойства) окислов металлов, играет доминирующую роль в каталитическом действии этих твердых тел. Как было объяснено ранее в этой главе, Вервей [26, 27] показал, что добавление одновалентных катионов, таких, как литий, к матрице из окисла никеля дает в результате увеличение числа дырок в этом окисле и, следовательно, повышает проводимость jj - типа. И, наоборот, при добавлении трехвалентных ионов ( таких, как хром) число дырок уменьшается и проводимость, следовательно, снижается. В нижней части рис. 23: Шваб приводит данные Вервея [26] и Хауффе [98], иллюстрирующие влияние добавленных ионов на проводимость закиси никеля. В верхней части рисунка приведены данные, полученные для реакции каталитического окисления окиси углерода. [14]
Страницы: 1
