Реакция - одноэлектронный перенос
Cтраница 1
Реакции одноэлектронного переноса имеют большое значение в биохимии. [1]
Своеобразным гибридом являются реакции одноэлектронного переноса, в которых могут образовываться ион-радикалы, которые реагируют дальше как с ионами, так и со свободными радикалами. Обычно реакции ион-радикалов причисляют к гемолитическим реакциям. [2]
Рассмотрена применимость метода химической поляризации ядер для изучения реакций одноэлектронного переноса на примере взаимодействия магнийор-ганических соединений с карбонильными соединениями, перекисями, дисульфидами и галогенорганическими соединениями. [3]
Приведенные правила позволяют не только определить электронную конфигурацию первичной радикальной пары в реакции одноэлектронного переноса, но также выяснить тонкие детали поведения радикалов в растворе. [4]
К числу других каталитических свойств парамагнитных ионов переходных металлов относится способность вступать в реакции одноэлектронного переноса, приводящие к образованию активных органических катион-радикалов. [5]
С помощью спиновых ловушек в этих случаях были обнаружены аддукты с радикалами RO, что могло свидетельствовать о преимущественном окислении спиртов по реакции одноэлектронного переноса с образованием радикалов RO. Между тем, спиновые ловушки в этих условиях значительно легче, чем спирты, вступают в реакцию одноэлектронного окисления. Возникающие при этом катион-радикалы спиновых ловушек в реакциях с нуклеофильными RO и приводят к образованию наблюдаемых аддуктов с радикалами RO. Таким образом, вопрос о том, как протекает окисление спиртов остается открытым; более предпочтительным нам представляется отрыв атома Н окислителем от алкильной группы спирта. [6]
Далее процесс осуществляется путем переноса с нафталинида натрия на более электронно-акцепторные ароматические системы угля, поэтому механизм электронного восстановления состоит в протекании реакций одноэлектронного переноса на ароматические системы. [7]
На схеме 6.4 показано образование стабилизированного резонансом феноксильного радикала из кониферилого спирта по реакции одноэлектронного переноса. [8]
Экспериментальные данные показали, что кобальтовый катализатор при его концентрации, сопоставимой с концентрацией субстрата, действует исключительно по С - Н - - связям а-углеводородного атома метильной группы п-адамантилтолуола и п-метилацетофенона. Данные кинетического анализа и квантово-химического расчета показали, что причиной столь высокой селективности окисления метильной группы в присутствии адамаш ильной или ацетильной группы в данной окислительной системе является возможное протекание реакции одноэлектронного переноса между субстратом и катализатором с образованием катион-радикала с последующей его стабилизацией путем отщепления протона. В адамантильной или ацетильной группе такой процесс невозможен из-за отсутствия протона у а-углеродного атома. Кроме того, при таком механизме реакции на стабилизацию катион-радикала значительное влияние оказывают стерические и полярные факторы, что также может указывать на большую реакционную способность метильной группы из-за наличия на атоме водорода этой группы большого положительного заряда Такое возрастание величины заряда относительно основного состояния и других атомов водорода связано с проявлением о-я-сопряжения ОН-связи метильной группы с бензольным кольцом. [9]
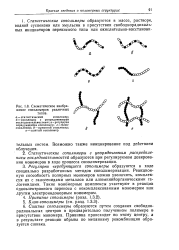 |
Схематическое изображение сополимеров различных типов. [10] |
Регулярно чередующиеся сополимеры образуются в ходе специально разработанных методов сополимеризации. Такие монбмерные комплексы участвуют в реакции одноэлектронного переноса с некомплексованным мономером или другим электронодонорным мономером. [11]
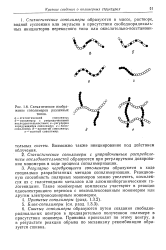 |
Схематическое изображение сополимеров различных типов. [12] |
Регулярно чередующиеся сополимеры образуются в ходе специально разработанных методов сополимеризации. Такие мономерные комплексы участвуют в реакции одноэлектронного переноса с некомплексованным мономером или другим электронодонорным мономером. [13]
Одна из важных причин относительно малой химической активности молекулы кислорода заключается в том, что эта молекула имеет два электрона с параллельными спинами. В результате взаимодействие кислородного атома с парой электронов какой-либо другой молекулы или атома затрудняется, так как оказывается необходимым повернуть спин; поворот спина - медленный процесс по сравнению со скоростью образования и распада переходных комплексов. Следовательно, малая активность молекулярного кислорода и его склонность к реакциям одноэлектронного переноса объясняется запретом по спину. [14]
В заключение мы рассмотрим еще один тип активных центров в цеолитах - электронодонор-ные или электроноаКцепторные центры. В 1964 г. была опубликована работа [81], авторы которой адсорбировали на обработанном в вакууме образце NH4Y соединения с относительно низкими ионизационными потенциалами, в частности трифениламин и дифенилэти-лены. Методом ЭПР было показано, что при комнатной температуре адсорбция этих соединений на активированных в вакууме цеолитах приводит к образованию катион-радикалов, концеш рация которых резко увеличивалась на образцах, вакуумированных при Гакт 500 С. Это дало авторам основание предположить, что процесс одноэлект-ронного переноса протекает с участием дегидроксилированных центров, хотя измеренное число спинов было на 2 порядка меньше теоретически возможной концентрации дегидроксилированных центров. По мнению авторов [82], даже молекулы с более высокими потенциалами ионизации могут при повышенных температурах участвовать в реакциях активированного одноэлектронного переноса, и образовавшиеся при этом катион-радикалы способны катализировать некоторые реакции. [15]
Страницы: 1