Реакция - пероксидной радикал
Cтраница 1
Реакция пероксидного радикала с такими ингибиторами всегда экзотермична. Значения q находятся в пределах 30 - 60 кДж / моль. [1]
Реакция пероксидных радикалов с ингибиторами III группы при определенных условиях вносит заметный вклад в их суммарное ингибирующее действие. Эти ингибиторы в таких случаях следует рассматривать как ингибиторы комплексного действия. [2]
В некоторых случаях реакция пероксидных радикалов с катализатором может приводить к образованию продуктов, неспособных к продолжению цепи. [3]
Быстрый обрыв цепей по реакции пероксидных радикалов с фенолами и ароматическими аминами, как уже отмечалось, связан с тем, что RO2 - - активные окислители, a InH - восстановители. Однако в окисляющихся углеводородах ингибиторы приходят в контакт и с другими окислителями, прежде всего с кислородом и гидропероксидами. Реакции ингибитора с этими окислителями могут отразиться на кинетике ингибированного окисления и длительности тормозящего действия ингибитора. [4]
Большое влияние на протекание реакций пероксидных радикалов оказывает диэлектрическая постоянная е среды. [5]
В присутствии ингибитора гидроперокси-ды образуются практически только по реакциям пероксидных радикалов с молекулами ингибитора и с радикалами In - ( реакции 7 8 см. с. [6]
К - константа равновесия между свободным и связанным водородной: связью пероксидным радикалом, kp [102] относится к реакции ассоциированного пероксидного радикала. [7]
Радикалы, образованные в результате реакции ( 1), способны реагировать с молекулой растворителя с образованием новых радикалов, которые, в свою очередь, могут претерпевать превращения, аналогичные реакциям пероксидных радикалов. [8]
Реакция пероксидных радикалов с соединениями металлов переменной валентности в некоторых случаях является причиной тормозящего действия этих типичных катализаторов окисления. Тормозящее действие прекращается, если в углеводород ввести гидропероксид; оно не наблюдается при введении солей металлов в углеводород, содержащий ROOH. Торможение вызывают только соединения металлов в состоянии низшей валентности и введенные в достаточно высокой концентрации. [9]
Камня [49] опытным путем показал, что при замене 20 % кобальта марганцем скорость окисления увеличивается в 5 раз. В этой работе дается объяснение наблюдаемому синергическо-му эффекту, связанному с ускорением реакции пероксидного радикала с активным бромидным комплексом, содержащим марганец, вследствие его сильного сродства к радикалу. [10]
О - Н - связь фенола атакуется, пероксидным радикалом намного быстрее чем С - Н - связь углеводорода. Различие в реакционной способности этих связей обусловлено прежде всего разницей в энергиях активации: ак-тивационный барьер для реакции пероксидного радикала с О - Н - связью фенола на 28 кДж / моль ниже энергии активации реакции RO2 - с С - Н - связью. [11]
 |
Результаты опытов по инициированному окислению топлива Т-6 с молибденом и дисульфидом молибдена. [12] |
При кинетическом режиме все определяет скорость реакции RCV с поверхностью. В этом случае скорость обрыва цепей vt ksS [ R O2 - ], где ks - константа скорости реакции пероксидных радикалов с поверхностью. [13]
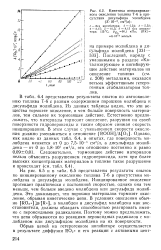 |
Кинетика инициированного окисления топлива Т-6 в присутствии дисульфида молибдена ( S-10-3, см2 / л. [14] |
На рис. 6.5 и в табл. 6.5 представлены результаты опытов по инициированному окислению топлива Т-6 в присутствии молибдена и дисульфида молибдена. Инициированное окисление протекает практически с постоянной скоростью, однако она тем меньше, чем больше введено молибдена или дисульфида молибдена. Это доказывает, что порошки материалов тормозят окисление, обрывая кинетические цепи. В условиях окисления обычно [ RO2 ] [ R ], а молибден и дисульфид молибдена как восстановители, должны обладать способностью реагировать именно с пероксидными радикалами. Поэтому можно предположить, что цепи обрываются по реакциям пероксидных радикалов с молибденом или дисульфидом молибдена на их поверхности. [15]
Страницы: 1