Реакция - взаимодействие - железо
Cтраница 1
Реакции взаимодействия железа уже неоднократно приводились нами в качестве примеров. Однако особенности фазовой диаграммы системы железо - кислород несколько осложняют картину окисления этого металла, причем эти осложнения не распространяются на реакции взаимодействия других металлов с кислородом. С учетом этой особенности и из-за большой технической важности железа и стали механизмам их окисления мы посвящаем отдельный раздел. [1]
Из реакции взаимодействия железа с окисью углерода в интервале температур 500 - 600 К с наибольшей глубиной превращения протекает реакция ( V-3), приводящая к образованию магнетита и цементита. Эта реакция, по-видимому, является основным процессом, обусловливающим наличие в порошковом карбонильном железе связанных кислорода и углерода. [2]
Из реакций взаимодействия железа с углекислотой следует, как уже отмечалось, что в интервале температур 500 - - 600 К реакция ( V-5), протекающая с образованием магнетита и окиси углерода, практически невозможна. Реакция ( V-6), приводящая к образованию магнетита и элементарного углерода, формально протекает с большой глубиной превращения. Однако уравнение ( V-6) является суммой удвоенного уравнения ( V-12) и уравнения ( V-5), поэтому, как и уравнение ( V-2), оно не должно приниматься во внимание. [3]
Провести реакцию взаимодействия железа с разбавленными соляной, серной и азотной кислотами. [4]
Согласно расчету реакция взаимодействия железа с аммиаком ( V-7), приводящая к образованию нитрида Fe4N и водорода, в рассматриваемых условиях процесса протекает с небольшой глубиной превращения. В действительности же порошковое карбонильное железо, полученное в присутствии аммиака, всегда содержит азот, связанный с металлом. Это указывает на то, что процесс воздействия аммиака на железо целиком не описывается уравнением ( V-7) и в действительности протекает более сложно, например, как это указывает ряд авторов, с образованием карбонитридов железа. [5]
Написать уравнение реакции взаимодействия железа с нитратом калия, учитывая, что продуктами реакции являются окись железа, окись калия и свободный азот. [6]
Влияние углерода на реакции взаимодействия железа с кислородсодержащими газами определяется в большой мере обезуглероживанием при температурах выше приблизительно 700 С. Как известно и как это неоднократно подтверждалось ( см., например, работу Остина [745]), обезуглероживание стали водородом сильно ускоряется IB присутствии водяного пара или при использовании листовой стали с цветами побежалости. Если углеродсодержащее железо соприкасается с газом, содержащим кислород даже в малой примеси, то образующаяся окись углерода создает значительное давление, зависящее от температуры, концентрации углерода в стали и концентрации кислорода Б газовой среде. Ясно, что выделение окиси углерода ( наряду с углекислым газом) должно отразиться на окислении сталей. [7]
Таким образом, реакция взаимодействия железа с углекислотой в реальных условиях процесса термического разложения Fe ( CO) 5, по-видимому, не имеет места. [8]
В основе процесса фосфатирования лежит реакция взаимодействия железа с фосфорной кислотой. [9]
В основе оксидирования стали лежит реакция взаимодействия железа со щелочью в присутствии окислителя. [10]
Составить схему перехода электронов, написать уравнение реакции взаимодействия железа с нитратом калия, учитывая, что продуктами реакции являются окись железа, окись калия и свободный азот. [11]
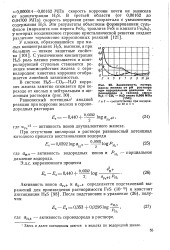 |
Зависимость потерь массы железа от рН раствора при парциальном давлении се. [12] |
С увеличением концентрации H2S роль пленки уменьшается и контролирующей ступенью становится реакция взаимодействия железа с сероводородом: кинетика коррозии отображается линейной зависимостью. [13]
На основании проделанного опыта к реакций взаимодействия железа с разбавленными серной и соляной кислотами сделать заключение о положении железа в ряду напряжений. [14]
Проведенный в 1991 г. комплексный анализ условий работы ТП ОНГКМ с учетом данных [131, 135, 142] позволил специалистам ЮЖНИИГИПРОГаза определить области эксплуатации ТП ОГКМ. При этом отмечено следующее. Доминирующим фактором развития коррозионного процесса является химический состав среды. Для протекания реакции взаимодействия железа с агрессивными компонентами необходим электролит - пластовая или конденсационная вода с растворенными в ней солями и кислыми компонентами. [15]
Страницы: 1