Реакция - синтез - аммиак
Cтраница 2
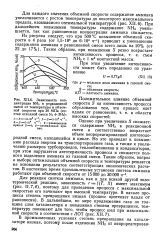
Реакция синтеза аммиака идет с выделением теплоты, которая используется обычно в самой колонне на подогрев исходных продуктов реакции, а в современных крупных агрегатах избыточная теплота частично используется для получения пара. На рис. 200 показано устройство колонны синтеза аммиака. Колонна с двойными теплообменпыми трубками состоит из катализаторной коробки вверху и теплообменника в нижней части. Исходная азотно-во-дородная смесь подается в верхний штуцер и проходит сверху вниз по узкой кольцевой щели между стенкой корпуса и внутренней па-садкой колонны. Холодный газ предохраняет корпус колонны от перегрева. В нижней части аппарата газ проходит в межтрубное пространство теплообменника 3, где нагревается за счет отходящих газов и по центральной трубе поднимается в верхнюю часть катализаторной коробки. В центральной трубе расположен элсктроподогрс-ватель 10, включающийся в период пуска и в случае переохлаждения колонны. Газ опускается по внутренним трубкам и поднимается по наружным. За время движения по наружным трубкам он нагревается за счет теплообмена с катализаторной зоной. После теплообменных трубок газ проходит сверху вниз слой катализатора, а затем трубки нижнего теплообменника. Из колонны он выходит с температурой 200 - 220 С. Через нижний штуцер по трубе в колонну вводится холодный газ в обход теплообменника ( холодный байпас) 6, который включается в случае недопустимого повышения температуры. [16]
Реакция синтеза аммиака из Н2 и N2 также имеет несколько большую начальную тенденцию к протеканию, чем обратная реакция разложения аммиака. [17]
 |
Механизм действия железного катализатора. [18] |
Реакция синтеза аммиака катализируется металлами, имеющими не полностью застроенные d - и / - электронные уровни. К ним относятся железо, родий, вольфрам, рений, осмий, платина, уран и некоторые другие металлы. [19]
Реакцию синтеза аммиака проводят в присутствии железного катализатора, содержащего небольшие количества ( 3 - 8 %) окислов алюминия, калия, кальция и кремния - так называемых промоторов. [20]
Реакцию синтеза аммиака проводят при высоком давлении и при температуре 490 - 530 С. В колонне среднего давления за один проход реагирует не более 15 - 25 % азотно-водородной смеси. Образовавшийся аммиак выделяется из газа, который затем возвращается обратно в систему. Таким образом, синтез аммиака является рециркуляционным процессом. В редких случаях применяют открытую схему, когда газ проходит последовательно несколько колонн, между которыми выделяется образовавшийся аммиак. [21]
Чтобы реакция синтеза аммиака могла идти на каком-либо катализаторе, на нем должна происходить хемосорбция либо одного, либо обоих реагирующих веществ. Мнение, что диссоциативная адсорбция азота является самой медленной стадией синтеза аммиака, подтверждается данными из независимых источников и поэтому разумно, по-видимому, сделать вывод, что те металлы, которые слабо хемосорбируют азот ( прочная хемосорбция должна ингибировать, а не усиливать реакционную способность) являются наиболее активными для синтеза аммиака. Вероятно, наиболее убедительным доказательством служит тот факт, что хотя большинство металлов способно адсорбировать водород, активными для синтеза аммиака являются только те металлы, которые могут хемосорбировать азот в виде атомов. Наиболее легко хемосорбируют азот переходные металлы, и эта тенденция возрастает при переходе от элементов, расположенных в правой части периодической системы, к элементам, находящимся в ее левой части, что следует из увеличения теплоты адсорбции азота, уменьшения энергии активации адсорбции и повышенной тенденции к образованию нитридов. Экспериментальные данные, полученные с помощью метода вспышки ( разд. Был сделан вывод, что для азота, адсорбированного в виде атомов, наиболее вероятна слабая хемосорбция. Вероятно, что кратность связи между металлом и атомарным азотом равна 3, и поэтому не является неожиданным тот факт, что наблюдаются высокие теплоты адсорбции и низкие степени заполнения поверхности. Поскольку металлы VIII группы, расположенные после осмия, обладают меньшим числом вакантных d - орби-талей, чем Fe, Ru или Os, становится понятным их неспособность как хемосорбировать азот в виде атомов, так и воздействовать на реакцию синтеза аммиака. [22]
Для реакции синтеза аммиака катализаторами могут быть железо, платина, осмий, марганец, вольфрам, уран, родий и другие металлы, имеющие в атоме второй снаружи незаполненный электронный слой. Наиболее высокую активность проявляют железо, осмий, рений и уран. [23]
Исследована реакция синтеза аммиака [402, 403] на железо-цеолитных катализаторах. Каталитическую активность измеряли на установке проточного типа при атмосферном давлении с использованием тщательно очищенной от следов кислорода, влаги и прочих примесей азото-водородной смеси стехиометрического состава. Установлено [402], что максимальную активность проявляют фожазиты FeNaX в температурном интервале 450 - 550 С. Эти образцы подвергнуты более детальному исследованию. Фожазит NaX в таком режиме не активен в реакции синтеза аммиака. [24]
 |
Зависимость концентрации NH3 в реакционной смеси от температуры и объемной скорости при 30 МПа ( состав исходной смеси NJ ЗЙ2. [25] |
Для реакции синтеза аммиака, как и для всякой другой экзотермической реакции, зависимость г f ( T, X) имеет максимум ( рис. II.7 б), поэтому для проведения процесса с максимальной скоростью его начинают при высокой температуре. [26]
Практически реакция синтеза аммиака проводится при температурах 450 - 500 С. Реакция з этих условиях протекает достаточно быстро, и содержание аммиака в газовой смеси сравнительно высоко. [27]
Для реакции синтеза аммиака катализаторами являются железо, платина, осмий, марганец, вольфрам, уран, родий и другие металлы, атомы которых характеризуются незаполненным вторым снаружи электронным слоем. Особенно высокая активность обнаружена при лабораторных исследованиях у осмия и урана. Однако условия использования катализатора в лаборатории и на заводе, перерабатывающем в сутки сотни тысяч и миллионы кубических метров газа, различны. Понадобились большие усилия, чтобы найти катализаторы, удовлетворяющие производственным требованиям. [28]
 |
Выход аммиака в зависимости от давления при объемной скорости 30000 и. [29] |
Для реакции синтеза аммиака катализаторами могут являться железо, платина, осмий, марганец, вольфрам, уран, родий и другие металлы, имеющие в атоме второй снаружи незаполненный электронный слой. Наиболее высокую активность проявляют осмий и уран. [30]
Страницы: 1 2 3 4