Реакция - титан
Cтраница 2
Для этого был поставлен ряд опытов по полимеризации этилена в присутствии треххлористого титана, полученного в результате реакции чстыреххлористого титана с этилалюмшшйсескви-хлоридом. [16]
Таким образом, для открытия титана в присутствии катионов, входящих в обычную систематику качественного анализа, необходимо: а) отсутствие в растворе окислителей; б) удаление ионов Ag, Hg22 и IIg2 ( или восстановление последнего до Hg224); в) восстановление Fe3 до Fe2 1, не реагирующего с хромотроповой кислотой и, наконец, г) создание в растворе рН, оптимального для прохождения реакции титана с хромотроповой кислотой. [17]
Для ряда веществ, относящихся к этой же группе, возникновение окраски связывается с правилом Гофманз-Резеншека и обусловлено определенным сочетанием окислите льна-восстзновитель-ных потенциалов реактива и катиона. Так, по-видимому, протекают реакции титана с ализарином S / 26 - 32 /, комплексоном Ш / 33 /, триоксиглутаровой кислотой / 34 / в присутствие восстановителей. [18]
Титан по распространенности занимает четвертое место среди технически важных металлов после алюминия, железа и меди. Выделение его из минералов связано с трудностями, обусловленными реакцией титана при нагревании с углем, кислородом и металлами. Получают чистый титан иодид-ным методом, термически разлагая его иодид. Роль металла как конструкционного материала быстро возрастает особенно в авиации, технике, промышленности ( рис. 77), в металлургии сплавов. Титан играет определенную роль в жизнедеятельности организмов: он непременный участник процессов иммуногенеза. Содержится в плазме крови, селезенке, надпочечниках и щитовидной железе. [19]
Навеску сплава растворяют при слабом нагревании в 10 % - ной ШЗСи и вводят несколько капель концентрированной HNO. Колонку промывают с той же скоростью водой до исчезновения в фильтрате реакции титана с перекисью водорода. Фильтрат и промывные воды отбрасывают. Через колонку пропускают 150 мл 5 % - ного раствора МШОН и 50 мл воды со скоростью не более 5 ла / мин. Фильтрат собирают в стакан емк. Полученный раствор нейтрализуют серной кислотой ( уд. [20]
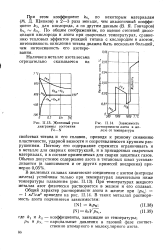 |
Железный угол. [21] |
По общим соображениям, по оценке степеней диссоциации кислорода и азота при сварочных температурах, сравнению тепловых эффектов реакций титана с кислородом и азотом, интенсивность окисления титана должна быть несколько большей, чем интенсивность его азотирования. [22]
 |
Характерное изменение электродного потенциала в вершине концентратора ( 1 и в основном металле, пассивирующемся ( 2 и частично пассивирующемся ( 3 с течением времени. [23] |
Например, титановые сплавы стойки против растрескивания в морской воде при отсутствии концентраторов напряжений и начальных трещин, так как в таком состоянии они покрыты прочной защитной окисной пленкой. При наличии концентраторов вследствие затрудненного доступа кислорода к вершине концентратора защитная пленка не образуется, так как в результате реакции титана с реагентами среды начальный запас кислорода в вершине концентратора исчерпывается. Поэтому при наличии напряженного состояния происходит интенсивное развитие трещин. [24]
Метод основан на образовании танталом с диметилфлуороном в умерен-нокислом растворе, содержащем щавелевую кислоту, розово-красного осадка комплексного соединения, остающегося в коллоидном растворе при малых количествах тантала. Nb, Mo, W, Zr и другие элементы маскируются полностью или частично щавелевой кислотой. Реакция титана подавляется добавлением перекиси водорода. Отделение тантала от большей части мешающих элементов производят экстракцией его фторокомплекса смесью ацетона с изобутанолом. [25]
Водород поглощается титаном в большом количестве. Растворимость водорода в f5 - Ti достигает 2 % и превышает растворимость водорода в железе в тысячи и десятки тысяч раз. В отличие от реакции титана с кислородом и азотом в случае взаимодействия с водородом пленка на поверхности металла при высоких температурах не образуется. По мере перегрева жидкого титана растворимость в нем водорода снижается. [26]
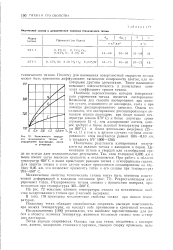 |
Зависимость твердости технического титана от содержания кислорода, азота и углерода. [27] |
Наилучшие результаты азотирования получаются на сплавах титана с ванадием и Оором. Цементация титана в твердой или газообразной среде не всегда дает положительные результаты. Так, слои толщиной 0 005 мм и выше имеют часто высокую хрупкость и отслаиваются. При работе в области температур 650 С и выше происходит реакция титана с атмосферными газами. Для защиты титана в этом случае может применяться силицирование на глубину 0 05 мм, что позволяет применять титан и его сплавы при температурах 950 - 980 С. [28]
Практически титан и его сплавы устойчивы во всех природных средах: атмосфере, почве, пресной и морской воде. Титан и особенно некоторые его сплавы имеют также высокую коррозионную стойкость и в ряде окислительных кислых сред, устойчивы в хлоридах, сульфатах, гипохло-ридах, азотной кислоте, царской водке, диоксиде хлора, влажном хлоре, во многих органических кислотах и физиологических средах. Отмечена повышенная стойкость титана и его сплавов по отношению к местным видам коррозии - питтингу, межкристаллитной, щелевой коррозии, коррозионной усталости и растрескиванию. Однако титан не стоек во фтористоводородной кислоте и кислых фторидах, а также концентрированных горячих щелочах, хотя и устойчив в аммиачных растворах. Титан не стоек в некоторых сильно окислительных средах - дымящей HNO3, сухом хлоре и других безводных галогенах, в жидком или газообразном кислороде, сильно концентрированной перекиси водорода. Реакция титана с этими средами может носить даже взрывной характер. [29]
Страницы: 1 2