Реакция - фтор
Cтраница 3
Несмотря на образование его в заметных количествах при реакции фтора с водой, существование OF2 было обнаружено [1 ] только в 1927 г. Очевидно, его принимали за озон, так как он энергично выделяет иод из растворов иодидов, а как известно [2], при реакции фтора с водой и со льдом образуются только следы озона. [31]
Так как прежние сообщения о выделении озона при реакции фтора с водой оказались ошибочными ( за озон принимался ОРз), то и эти данные за-луживают проверки. [32]
Монофхорид хлора был открыт в результате многочисленных исследований реакций фтора с хлором и его производными при различных условиях. Так, Муассан [1, 2] и Лебо [3], исследуя возможность образования соединений между фтором и хлором при комнатной температуре, не отметили какой-либо реакции. Следующие попытки по изучению взаимодействия фтора с хлором были предприняты Руффом и Цеднером [4] в 1909 г. Ими было поставлено две серии опытов. [33]
Четырехфтористый церий, который может быть получен непосредственно реакцией фтора с двуокисью церия или трехфто-ристым церием, является фторирующим агентом того же общего типа, как и три описанных выше, и изредка применяется в аналогичных процессах фторирования. [34]
Четырехфюристый церий, который может быть получен непосредственно реакцией фтора с двуокисью церия или трехфто-ристым церием, является фторирующим агентом того же общего типа, как и три описанных выше, и изредка применяется в аналогичных процессах фторирования. [35]
Образование монофторида брома может иметь место не только при реакции фтора с бромом. [36]
Широко применяемая методика определения газообразного фтора, основанная на реакции фтора со ртутью с образованием фторида ртути и последующем измерении давления [2-4] не применима для анализа фторидов хлора, так как хлор также реагирует с ртутью. В лучшем случае ее применение возможно для определения инертных примесей в газе. [37]
Выход фтора по току зависит от протекания в электролизере реакций фтора с примесями, которые могут попадать в расплав. [38]
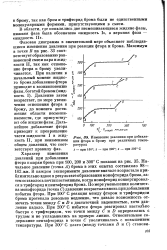 |
Изменение давления при добавлении фтора к брому при различных температурах 1 - при 100. г - при 200. з - при 300 С. [39] |
Фазовая диаграмма в значительной мере объясняет наблюдавшиеся изменения давления при реакции фтора и брома. Максимум в точке В на рис. 33 соответствует образованию равновесной смеси пара и жидкости II, так как отношение фтора к брому увеличивается. Давление затем возрастает, по мере увеличения отношения фтора к брому, до момента достижения области несмешиваемости, где присутствуют обе жидкие фазы. Дальнейшее добавление фтора приводит к превращению части жидкости I в жидкость II, при неизменном общем давлении, что соответствует правилу фаз. [40]
Фторирование элементарным фтором: а) некаталитическое фторирование вследствие высокой теплоты реакции неразбавленного фтора с органическими соединениями сопровождается взрывом или образованием угля и имеет ограниченное применение. Первые попытки были предприняты еще в 1886 г. французским химиком А. [41]
Руфф и Хайнцельманн [1] в 1909 г. успешно получали гексафторид урана реакцией фтора с металлическим ураном, карбидом урана и пентафторидом его. В 1941 г. Абельсон ( Национальное бюро стандартов) сообщил о применении тетрафторида урана в качестве материала для реакции с элементарным фтором. На основе этого процесса Дюпоном [3] был спроектирован и построен завод. Реакция велась в двух никелевых трубках, работающих последовательно. [42]
Фторирование элементарным фтором; а) некаталитическое фторирование, вследствие высокой теплоты реакции неразбавленного фтора с органическими соединениями, сопровождается взрывом или образованием угля и имеет ограниченное применение. Первые попытки были предприняты еще в 1886 г. французским химиком А. [43]
Кроме реакций фтора с водородом и галогензамещенными метана, в настоящее время изучены реакции фтора с рядом других органических веществ и с НС1, НВг и HJ. Для всех этих реакций характерно энергетическое разветпленио цепей, которые в данном случае можно назвать радикально-энергетическими цепями. [44]
Высокая активность свободного элемента частично обусловлена слабостью F-F - связи в молекуле фтора и высокой экзотермич-ностью реакций атомного фтора. Несмотря на то что в течение долгого времени трудно было точно измерить энергию диссоциации, величина 37 7 6 2 ккал / моль представляется в настоящее время хорошо установленной. [45]
Страницы: 1 2 3 4