Реакция - электровосстановление - кислород
Cтраница 2
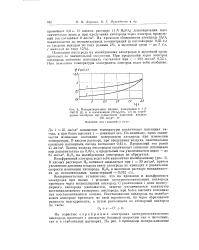 |
Поляризационные кривые, измеренные в 1 / V NaOIi ( 1 и в насыщенном ( N114 2804 ( И на серебряном электроде при. избыточном давлении воздуха 400 мм рт. ст. [16] |
Экспериментально установлено, что на хромовом и вольфрамовом электродах при малых г реакция электровосстановления кислорода протекает через молекулярный кислород. С увеличением г доля молекулярного кислорода уменьшается, заметно увеличивается количество восстанавливаемого атомарного кислорода, при более высоких потенциалах восстанавливаются окислы. [17]
В литературе имеются два основных подхода к объяснению промотирующего действия шпинелей в реакции электровосстановления кислорода на углеродных материалах. В работах [40, 102] высказано предположение, что в присутствии оксидов - промоторов реакция протекает только через промежуточное образование пероксида водорода, а промотирующий эффект обусловлен гетерогенным разложением пероксида водорода шпинелями. [18]
Рассмотрим первоначально данные о величине электрокаталитической активности углеродных материалов, промотированных микроосадками благородных металлов, в реакциях электровосстановления кислорода, электроокисления водорода и органических веществ: метанола и углеводородов. [19]
 |
Стандартные электродные потенциалы и токи обмена цинка, кадмия и свинца. [20] |
Для того, чтобы навязать необходимый потенциал катоду при замыкании его с анодом через внешнее сопротивление, ток обмена на аноде должен быть на 1 - 2 порядка выше, чем ток обмена реакции электровосстановления кислорода на катоде. [21]
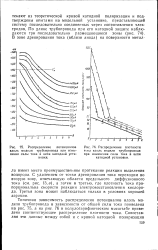 |
Распределение плотности. [22] |
С удалением от точки дренирования тока переходим во вторую зону, отвечающую области предельного диффузионного тока ( см. рис. 13 в), а затем в третью, где плотность тока пропорциональна скорости реакции электровосстановления кислорода. Третья зона может наблюдаться только в условиях хорошей аэрации. [23]
Как указывалось ранее, малая скорость электроокисления гидразина реализуется на графите и активном угле. В то же время активный уголь имеет высокую каталитическую активность относительно реакции электровосстановления кислорода. Поэтому в качестве катодов кислородно ( воздушно) - гидразиновых элементов можно рекомендовать угольные электроды. Как было показано ранее, особенно малую каталитическую активность в реакции электроокисления гидразина имеют магний, кадмий и нержавеющая сталь. [24]
Состояние полной защиты, достигаемое в результате катодной поляризации, отвечает динамичестому равновесию реакций ио ни зации и разряда ионов металла. Одновременно на поверхности катодно защищаемого металла, независимо от указанных, протекают реакции электровосстановления кислорода и разряда ионов водорода. Суммарная скорость последних при достижении защитного потенциала определяется плотностью тока поляризации. Баланс, зарядов в системе катодной защиты обеспечивается за счет растворения анодного заземления или протектора. [25]
Настоящая статья посвящена изложению некоторых закономерностей реакции катодного восстановления кислорода на гладких металлах платиновой группы - платине [1, 3-9], палладии [10], родии [ И, 12 ] и рутении [13], установленных главным образом с помощью упомянутого выше метода. При этом будут рассмотрены три основных акспекта проблемы: 1) путь реакции электровосстановления кислорода; 2) характер отдельных стадий процесса; 3) влияние поверхностных окислов металла на кинетику реакции. [26]
В последнее время [168, 169] для модифицирования углеродной поверхности были использованы биядерные ковалентно связанные ( face-to - face) порфирины. При адсорбции на пирографите мономера и биядер-ного димера кобальта с соединительной цепочкой из шести атомов реакция электровосстановления кислорода в кислой среде ( 0 5 М НС1О4 или СРзСООН) ускоряется по сравнению с чистым пирографитом, но протекает через промежуточное образование пероксида водорода. [27]
Катод гидра-зинового топливного элемента предназначен для элек-тров Ъсстановления кислорода. Он представляет собой устройство, состоящее, по меньшей мере, из проводника первого рода, катализатора реакции электровосстановления кислорода и системы пор, обеспечивающей контакт газа, раствора электролита и проводника первого рода. К электроду подают либо кислород, либо воздух. [28]
В табл. 23 сопоставлены электрохимические характеристики углей [277], пористая структура которых описана в I части книги. Эти данные соответствуют кинетическому режиму генерации тока и наклону lg /, - кривой - 2 3 RT / F. Наибольшей активностью в реакции электровосстановления кислорода обладают угли серий КМ и К. [29]
На аноде идет процесс ионизации металла. На катодных участках в зависимости от химического состава раствора могут идти самые разнообразные катодные реакции, равновесные потенциалы которых более положительны, чем потенциал анодного участка ( см. табл. 6): реакция электровосстановления кислорода, реакция разряда ионов водорода, реакция разряда ионов металла и другие. [30]
Страницы: 1 2