Реакция - вытеснение - водород
Cтраница 1
Реакции вытеснения водорода металлами из кислот также являются окислительно-восстановительными процессами. [1]
 |
Взаимодействие натрия с водой. [2] |
Для реакции вытеснения водорода из воды не следует пользоваться менее активными металлами, такими как магний и алюминий. Образующиеся гидроксиды магния и алюминия практически не растворимы в воде. Они образуют на поверхности кусочков металла нерастворимую пленку, защищающую металл от действия воды, поэтому реакция прекращается после выделения первых же пузырьков водорода. [3]
Для реакции вытеснения водорода из воды не следует пользоваться менее активными металлами, такими, как магний и алюминий. Образующиеся гидраты окисей магния и алюминия практически нерастворимы в воде. Они обволакивают кусочки металла нерастворимой пленкой и разобщают поверхность металла от воды, поэтому реакция прекращается после выделения первых же пузырьков водорода. [4]
Основной реакцией процесса коррозии металла при его контакте с водой или с влажным воздухом является реакция вытеснения водорода. [5]
Гидриды магния и бериллия, как правило, более активны, чем гидриды кальция, стронция и бария. Как и для гидридов подгруппы IA, для этих гидридов характерны реакции вытеснения водорода, передачи водорода другому элементу и присоединения. [6]
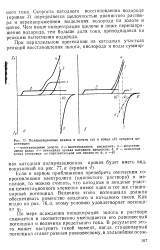 |
Поляризационные кривые в начале ( а н конце ( б процесса цементации. [7] |
Скорость катодного восстановления водорода ( кривая 3) определяется щелочностью цианистого раствора и перенапряжением выделения водорода на золоте и - цинке. Чем выше концентрация щелочи и ниже перенапряжение водорода, тем больше доля тока, приходящаяся на реакцию вытеснения водорода. [8]
Подобная методика дает возможность исследовать многие реакции, в которых образуются газообразные продукты. Практический интерес представляют реакции вытеснения водорода металлами из растворов разбавленных кислот. [9]
Как видно из табл. 2, наиболее отрицательные значения потенциалов имеют щелочные металлы, магний, алюминий, марганец, цинк. Потенциалы остальных восстановителей различаются мало. Применение восстановителей, потенциалы которых отрицательнее потенциала водородного электрода, в водных растворах осложняется протеканием реакции вытеснения водорода из воды. [10]
Механизм действия сульфгидрильных ускорителей Бедфорд представляет в таком виде. Сначала они образуют с сероводородом солеобразные сульфгидрильные продукты присоединения. Предполагается, что сероводород выделяется в результате взаимодействия серы с примесями каучука или в результате реакции вытеснения водорода из самого каучука. Солеобразные продукты присоединения реагируют с элементарной серой резиновой смеси, образуя полисульфиды, аналогичные много-сернистому аммонию. [11]
Чтобы избежать различных ошибок, Букуолтер и Вагнера рекомендуют производить бромирование при определенной температуре с помощью раствора брома в четыреххлористом углероде. Затем следует удаление избытка брома вместе с образовавшимся НВг если одновременно с реакцией присоединения произошла в некоторой мере и реакция вытеснения струей сухого азота и поглощение этих газов водным раствором KJ-Иод, вытесненный бромом, оттитровывают тиосульфатом, затем добавляют иодат калия, который выделяет иод соответственно содержанию в растворе свободной кислоты. Последний также оттитровывают тиосульфатом. Каждый эквивалент образовавшейся НВг показывает потерю двух эквивалентов брома на реакцию вытеснения водорода, считая, что сам продукт броми-рования не отделяет НВг. Оптимальная температура бромирова-ния различна для разных веществ. [12]
Из дальнейших исследований Н. А. Изгарышева выяснилось, кроме того, что явления пассивности выражены в спирте и пиридине резче, чем в воде. Так, например, кобальт, немедленно пассивирующийся в спирте, быстро активируется в водных растворах до известного предела, а затем опять постепенно принимает более электроположительный потенциал. Прибавление воды, даже в небольших количествах, к спиртам и пиридину сильно ослабляет их пассивирующие свойства. Это объясняется, невидимому, тем, что в безводном спирте реакция вытеснения водорода неблагородными металлами практически не осуществляется и совершенно невозможна в пиридине. Вследствие этого окислительные процессы протекают свободно, не встречая антагонистического действия водорода, отчасти разрушающего окисные пленки. [13]
Страницы: 1